タンパク質構成アミノ酸の構造と特徴
UBC/aa_carbo_lipid/aa/alpha_aa_overview
広告
タンパク質構成アミノ酸の構造と特徴
アミノ酸 amino acid は、広義には
狭義には、タンパク質の構成成分である α-アミノ酸を指す。α-アミノ酸には、以下のような構造的な特徴がある。
- カルボキシル基 -COOH とアミノ基 -NH2 の両方が同じ炭素原子に結合している。この炭素を α 炭素という。
- α 炭素に様々な側鎖 (図の R、このページで青字で示す部分) が結合しており、側鎖によってアミノ酸の性質が決まる。
- アミノ酸には、光学異性体の D 型 と L 型がある。一般にタンパク質を構成するのは L 型のアミノ酸である。しかし、これを説明する合理的な理由は不明である。なお、D と L は
小さいフォントで表記する というルールがあるが、このサイトでは表記が難しくなるのでやっていない。
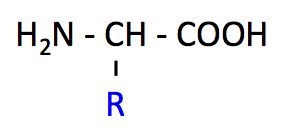
アミノ酸の炭素番号の付け方 のページには、炭素番号についての詳細な記述がある。このページで、構造に赤い数字で示してあるのが炭素番号である。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
リンク
グリシン (Glycine, Gly, G)
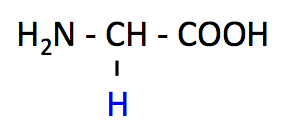
- pK1 (COOH) = 2.4
- pK2 (NH3+) = 9.8
アラニン (Alanine, Ala, A)
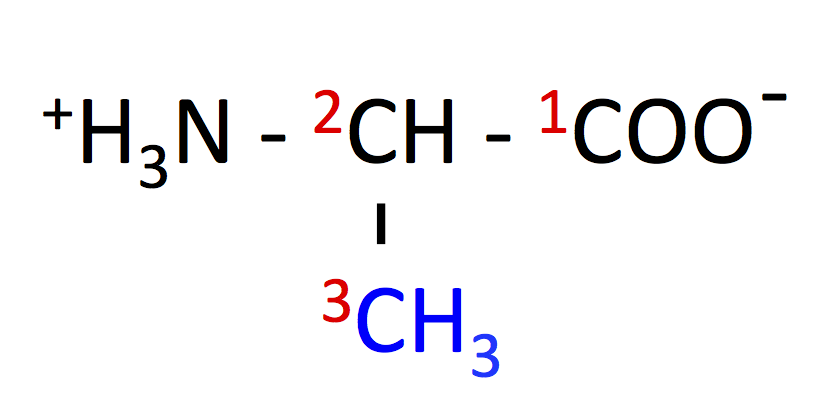
- アラニンのページ、NMR による Ala の検出
- 乳酸 とともに、肝臓 での 糖新生 の主な原料となる。
- 解糖系 の最終産物である ピルビン酸 から合成される。
- 解糖系の律速酵素、ピルビン酸キナーゼに結合し、活性を阻害する。
- アミノ酸分解の際、窒素を肝臓へ輸送する役割がある。
- pK1 (COOH) = 2.4
- pK2 (NH3+) = 9.9
広告
ロイシン (Leucine, Leu, L)
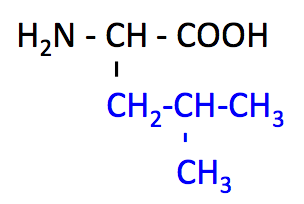
- Gly および Ala と同様に、側鎖が炭化水素基のみでできている。
- しかし Leu の側鎖には分岐があるため、Val, Ile とともに 分岐鎖アミノ酸 に分類される。BCAA は全て必須アミノ酸である。
- インスリン 分泌を刺激する作用がある。
- 筋肉のタンパク質合成を促進、分解を阻害。
- 側鎖の 2 つのメチル基の炭素番号は、5 および 5' と表す。
- Leu のページ
- 英語の発音 [l
u ːsiːn] - pK1 (COOH) = 2.3
- pK2 (NH3+) = 9.7
- 必須、分岐鎖
イソロイシン (Isoleucine, Ile, I)
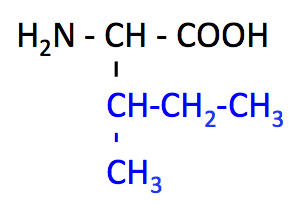
- Ile のページ
- 英語の発音 [ʌisəl
u ːsiːn]
- pK1 (COOH) = 2.3
- pK2 (NH3+) = 9.8
- 必須、分岐鎖
- Leu の構造異性体。側鎖のメチル基 -CH3 の位置が違うだけ。
- 側鎖にも不斉炭素原子がある。
- 炭素番号は、側鎖の長い方へ向かって 1 から 5 とつけ、3 番の炭素についているメチル基は 3' となる。
バリン (Valine, Val, V)
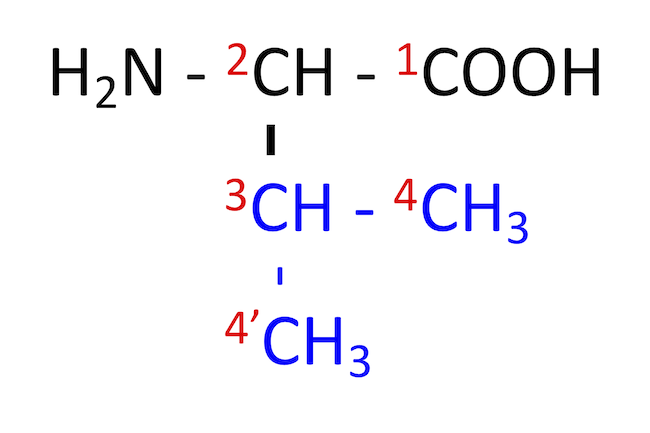
- Val のページ
- 英語の発音 [v
e ilːn] - pK1 (COOH) = 2.2
- pK2 (NH3+) = 9.7
- 必須、分岐鎖
- 脳における取り込み量が、アミノ酸の中でもっとも高い。
- 側鎖の 2 つのメチル基の炭素番号は、4 および 4' と表す。
システイン (Cysteine, Cys, C)
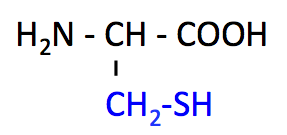
- Cys のページ
- pK1 (COOH) = 1.9
- pK2 (NH3+) = 10.7
- pK3 (側鎖) = 8.3
- Cys と Met は、側鎖に硫黄 S を含む含硫アミノ酸。
- チオール基 -SH がジスルフィド結合を作り、タンパク質の構造を安定化する。
- -SH 基は酸化修飾を受けやすい。
メチオニン (Methionine, Met, M)
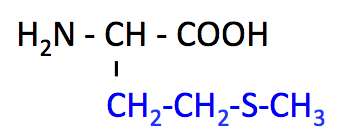
- Met のページ
- pK1 (COOH) = 2.1
- pK2 (NH3+) = 9.3
- 必須
アスパラギン (Asparagine, Asn, N)
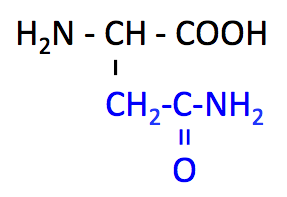
- Asn のページ
- pK1 (COOH) = 2.1
- pK2 (NH3+) = 8.8
- アスパラガスから発見されたためにこの名がついた。
- 非必須アミノ酸。TCA 回路 の中間体から合成される。
- 側鎖がポリペプチド骨格と水素結合を形成できるため、α-helix の始点および終点、β-シートのターンの部分などに位置する。
- 糖鎖付加 N-linked glycosylation を受ける。
アスパラギン酸 (Aspartate, Asp, D)
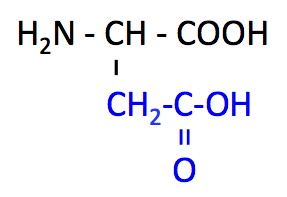
- Asp のページ
- pK1 (COOH) = 2.1
- pK2 (NH3+) = 9.9
- pK3 (側鎖) = 3.9
- Asn の側鎖で、-NH2 の部分が -COOH になっている。この関係は、Glu と Gln でも同じである。
- Glu とともに、側鎖の -COOH から H+ を放出する 酸性アミノ酸。
- 興奮性神経伝達物質、うま味成分。
- ピリミジン合成の出発点。
グルタミン (Glutamine, Gln, Q)
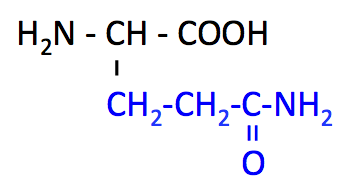
- Gln のページ
- pK1 (COOH) = 2.2
- pK2 (NH3+) = 9.1
- Asn よりも -CH2 が 1 個多い。
- Glu からの Gln 合成は、アンモニア NH3 の解毒反応として重要。
グルタミン酸 (Glutamate, Glu, E)
|
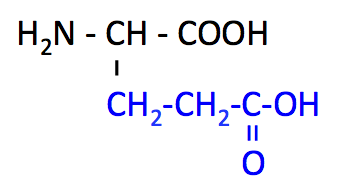 |
- Asp とともに、側鎖の -COOH から H+ を放出する 酸性アミノ酸。
- 興奮性神経伝達物質、うま味成分。抑制性神経伝達物質 GABA の材料。
- TCA 回路 の中間体 α-ケトグルタル酸から合成される。
アルギニン (Arginine, Arg, R)
|
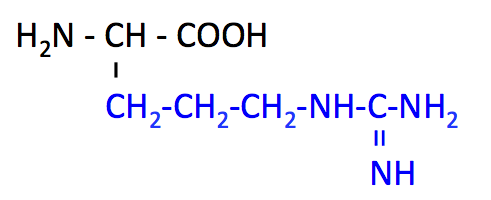 |
- Lys とともに、側鎖の -NH2 が中性付近で電子を受け入れる 塩基性アミノ酸。
- 非必須アミノ酸ではあるが、成長期には摂取が必要とされる。
- タンパク質構成アミノ酸のなかで、もっとも塩基性が高い。つまり側鎖の pKa が高い。
リシン (Lysine, Lys, K)
|
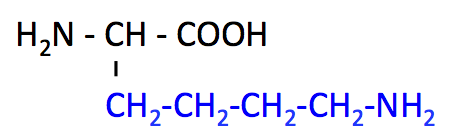 |
- Arg とともに、側鎖の -NH2 が中性付近で電子を受け入れる 塩基性アミノ酸。
- メチオニンとともに、脂質をミトコンドリアへ輸送するカルニチンの原料。
- タンパク質分解の指標である ユビキチン が結合する。
2019/3/13 一文字表記が間違っていたので修正しました。ご指摘ありがとうございました。
広告
セリン (Serine, Ser, S)
|
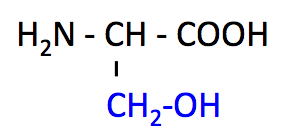 |
スレオニン (Threonine, Thr, T)
|
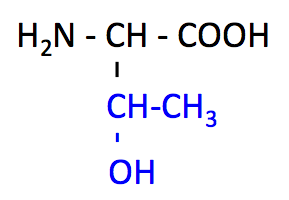 |
- Ser, Tyr と同様に、側鎖の -OH 基でリン酸化される。
- 血液脳関門 を通過でき、脳では Gly, Ser に変換される。
- 側鎖に不斉炭素原子がある。
チロシン (Tyrosine, Tyr, Y)
|
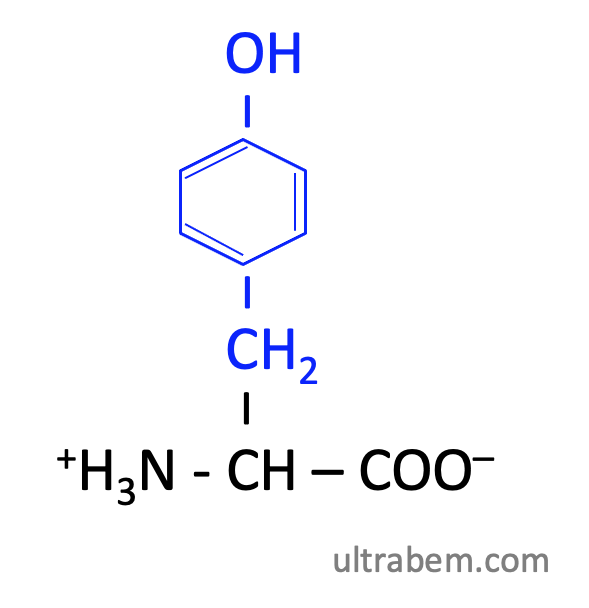 |
フェニルアラニン (Phenylalanine, Phe, F)
|
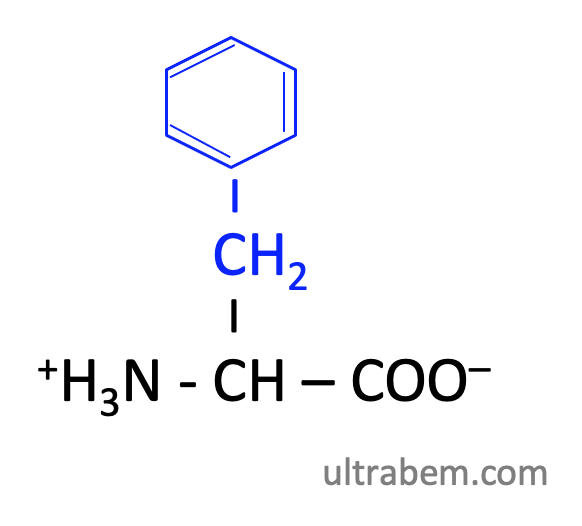 |
- Ala にフェニル基がついている。チロシンの前駆体。
- Phe, Trp とともに芳香族アミノ酸。芳香族中ではもっとも疎水性が高い。
- 芳香族ではあるが 280 nm の吸光度は低いので、280 nm 法ではタンパク質濃度に寄与しない。
トリプトファン (Tryptophan, Trp, W)
|
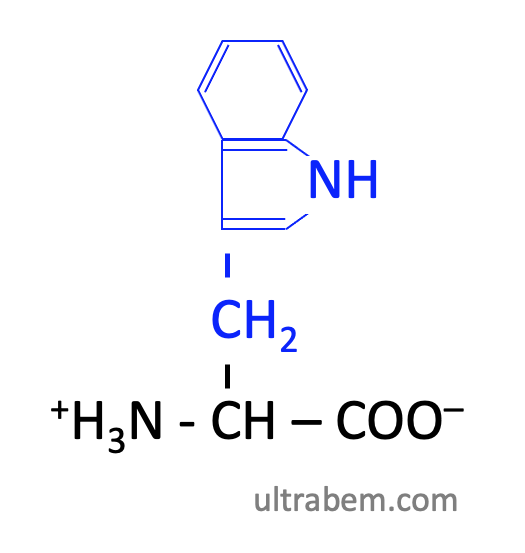 |
- Phe, Tyr とともに芳香族アミノ酸。
- セロトニンの前駆体。
ヒスチジン (Histidine, His, H)
|
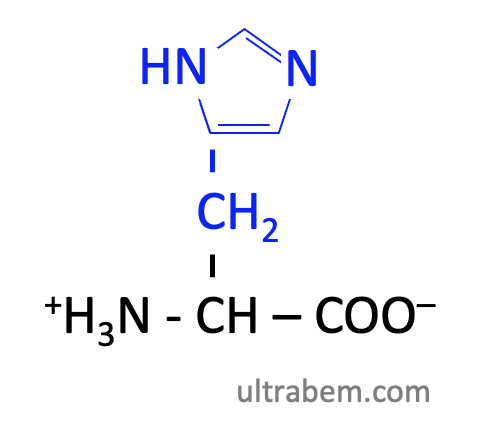 |
- 側鎖にイミダゾイル基をもつタンパク質構成アミノ酸はこれだけ。
- 酸にも塩基にもなれるという特殊なアミノ酸。イミダゾール環の N の pKa が 6.0 なので、中性付近で H+ の授受が可能。
- そのため、酵素の活性中心になることが多い。局所的な条件によってプロトンを自由に扱えるためである。
- 金属イオンと配位結合を形成することができる。これは、イミダゾール環の水素と結合していない方の N が電子対をもっているためである。
- ヒスタミン、カルノシン生合成の前駆体。
- 大腸菌発現系で、6 x His がタグとしてよく用いられる。
プロリン (Prorine, Pro, P)
|
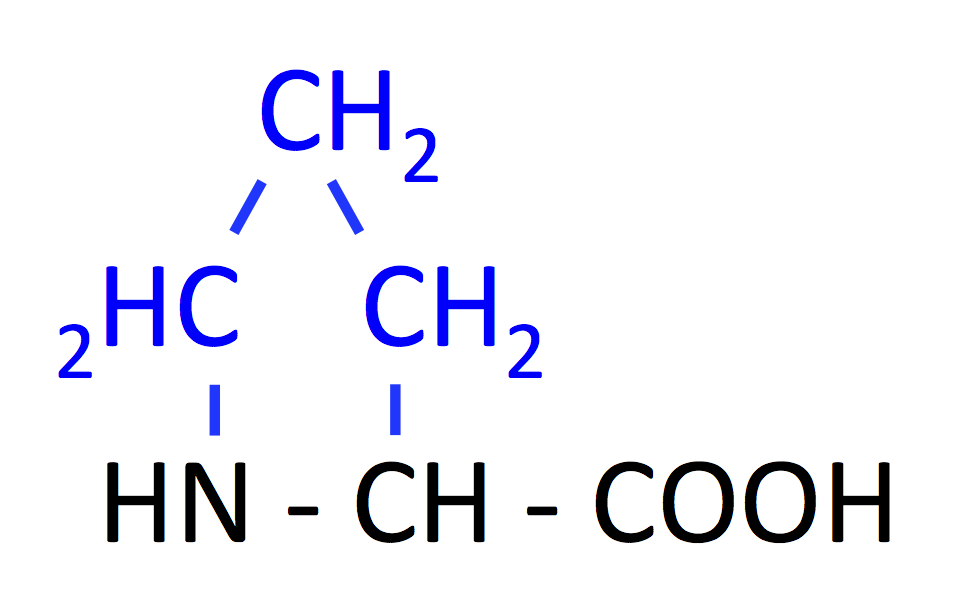 |
- アミノ基 -NH2 の部分が -NH になっているので、厳密にはアミノ酸ではない。
- 環状構造がタンパク質の構造に大きく影響する。Pro が含まれていると α-helix 構造が不安定になる。
広告
References
IUPAC-IUB Joint Commission on Biochemical Nomenclature, 1984a. Nomenclature and Symbolism for Amino Acids and Peptides. Eur. J. Biochem. 138. 9-37. Link: Last access 2018/07/25.- Amazon link:
Hine (2015). Oxford Dictionary of Biology.
コメント欄のアップデート前、このページには以下のようなコメントを頂いていました。ありがとうございました。
|
2018/02/21 07:03 試験前にチェック! 素晴らしいです。。。 |
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
