側鎖の長い塩基性アミノ酸 リジン:
構造、機能、代謝など
- 概要: Lys とは
- Lys の生合成
- Lys の分解
- Lys 修飾
- アセチル化
広告
概要: リジンとは
リジン Lys は長い直鎖状の側鎖をもつアミノ酸である。
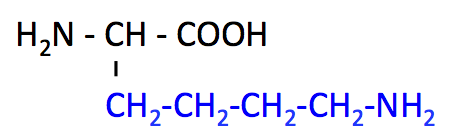
- pK1 (COOH) = 2.2
- pK2 (NH3+) = 9.2
- pK3 (側鎖) = 10.8
- 必須、塩基性
リジンは、ドイツの研究者 Drechsel によって 1889 年に牛乳のタンパク質・カゼイン から発見された。1928 年に Vickery and Leavenworth によって結晶化された。
リジンの重要な生化学的特徴は以下の通り。
- 生物が合成できない
必須アミノ酸 essential amino acid である。 - タンパク質に含まれる Lys は、
アセチル化 によるタンパク質修飾の標的となる。 - 生理的条件下では、側鎖のアミノ基 -NH2 がプロトンを受け入れて -NH3+ になっている。つまり塩基性アミノ酸であり、荷電アミノ酸である (参考: 酸・塩基の定義)。
- 脂質の輸送に関わる カルニチン の原料になる。
リジンの類縁体である allysine は、リジンから lysyl oxidase によって合成されるアミノ酸である。細胞外マトリクス extracellular matrix のタンパク質、コラーゲン collagen やエラスチン elastin の架橋に使われる。
Lys の生合成
リジンは、哺乳類 が生合成できない必須アミノ酸である。バクテリア、藻類および 植物 では、少なくとも 6 種類の生合成経路が知られている。
生合成経路は、diaminopimelate (DAP) 経路および L-2-aminoadipate 経路に大別される。後者は α-aminoadipate 経路とも呼ばれる。
Diaminopimelate pathway 経路は、バクテリアおよび菌類に存在し、ペプチドグリカン合成に関わっている。そのため、この経路は多くの抗生物質の標的となっている。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
Lys の分解
Lys の分解は alpha-ketoglutarate および saccharopine dehydrogenase によって触媒される NADH 依存的な反応である。まず Lys および lysine 2-oxoglutarate が結合して saccharopine になる。この経路は saccharopine pathway と呼ばれる。その後、この分子は複数の分子を経て最終的に acetoacetyl-CoA になる。
Lys の修飾
アセチル化
Lys のアセチル化は、とくに核 nucleus の中で DNA と結合しているタンパク質・ヒストン histone において有名である。遺伝子発現のエピジェネティック epigenetic な制御に関わる。
ヒストンのアセチル化では、タンパク質中の特定の Lys の
- ミトコンドリアではアセチル CoA 濃度が 0.1 - 1.5 mM と高く、pH も高いため非酵素的反応が起こる。
- したがって、ミトコンドリアタンパク質の Lys の多くはアセチル化修飾を受けている。
> ミトコンドリア外ではアセチル CoA 濃度が 0.002 - 0.013 mM と低い (2)。
- したがって Lys は一般に酵素的にアセチル化される。
- 塩基性アミノ酸に隣接する Lys は、ミトコンドリア外でもアセチル化を受けやすい。
ヒストンの Lys の脱アセチル化酵素は
References
- Berg et al. Biochemistry: 使っているのは 6 版ですが 7 版を紹介しています。
Su et al. 2016a (Review) . Metabolic control of methylation and acetylation. Curr Opin Chem Biol 30, 52-60.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
