タンパク質の概要
UBC/protein_gene/protein_gene_meta/protein_overview
このページの最終更新日: 2025/11/23- 概要: タンパク質とは
- タンパク質の構造
- タンパク質の分解
- タンパク質の修飾
広告
概要: タンパク質とは
タンパク質は 20 種類の アミノ酸 を主要な構成因子とする生体高分子で、その機能は多岐にわたる。以下の 4 つがタンパク質の重要な特徴として知られている (1).
- アミノ酸から成るポリマーで、3 次構造をとる。
- 多くの官能基 functional group を含む。これらの官能基は chemically reactive である。
- タンパク質は、他の生体高分子と複合体を形成する。
- タンパク質は、ものによって rigid または flexible な構造をとることができる。
このページには、タンパク質に関する全体的な内容をまとめる。個々のタンパク質のページへのリンクは、タンパク質の目次 のページにアルファベット順にまとめている。また、以下のようなタンパク質関連のページがある。
- タンパク質の輸送
- 抗体について
- 実験方法の目次 に 280 nm 法、SDS-PAGE などタンパク質実験の項目あり
- 栄養素としてのタンパク質 → とりあえずはメモとして タンパク質中毒 をリンクしておく。
タンパク質の構造
一次構造
アミノ酸の並びを一次構造 primary structure という。
最初に一次構造が決定されたタンパク質はインスリンであり、1953 年にサンガー法で有名な Frederick Sanger らが報告した。このことは、タンパク質が適当なアミノ酸の繋がりではなく、厳密に規定されたアミノ酸配列をもっていることを示したという意味で、生化学上の重要な発見である (1)。
ペプチド結合 (図; ref 3) は、C=O の二重結合が C-N の結合と共鳴しており、C=N 二重結合という性質ももっている。原子間距離も C-N と C=N のちょうど中間の 1.32 オングストロームである。そのため、この結合は
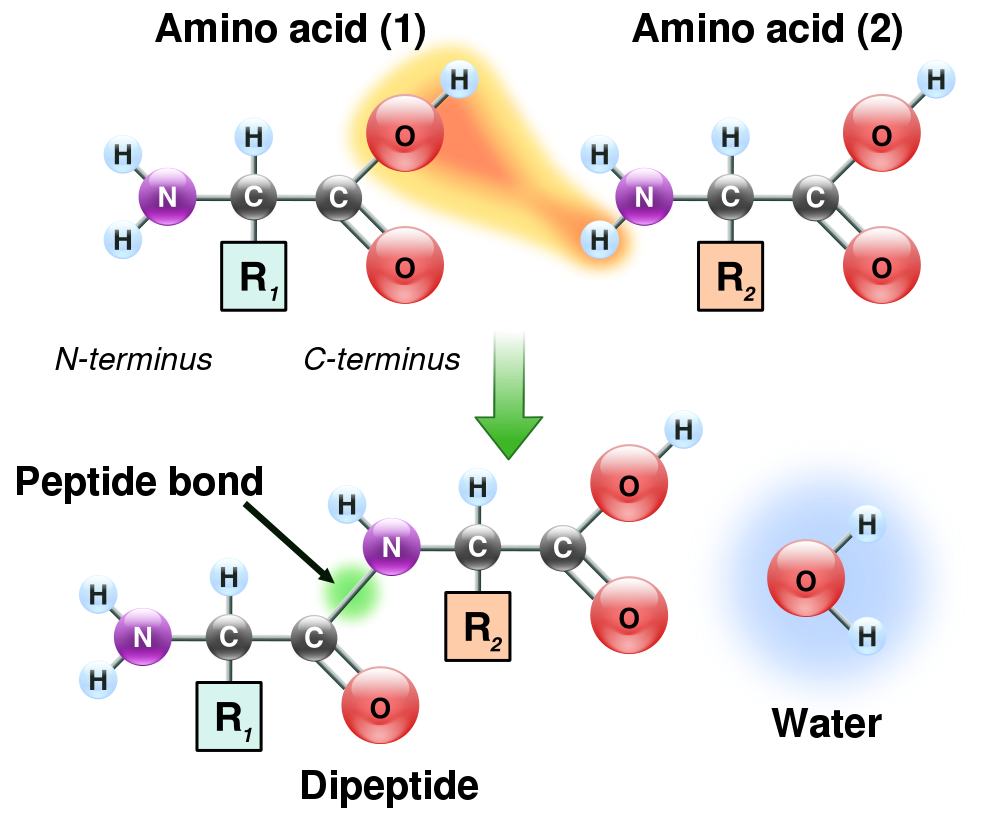
ペプチド結合の絶対配置は、原則としてトランス型である (1)。これは、シス型だとアミノ酸の側鎖が互いに干渉するためである。ただし、Pro はその特殊な構造のため、シス型の結合をする傾向がある。
二次構造
ポリペプチド鎖のとる決まった繰り返し構造を二次構造 secondary structure という。α helix, β sheet などが有名である。
これらのほか、turn や loop もタンパク質の構造を決定する重要な二次構造である。
三次構造
タンパク質の構造的区分は
四次構造
複数のポリペプチドによる複合体の形成。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
タンパク質の分解
アミノ酸同士を繋いでいるペプチド結合 -CO-NH- は、以下のように加水分解される。
しかし、適切な pH 下ではこの反応は
タンパクの分解に関わるシステムおよび酵素を簡単な表にまとめておく。これらのメカニズムによって、毎日 1 - 2% のタンパク質が分解、リサイクルされている (4)。
消化系 |
|
| プロテアソーム系 |
|
| オートファジー系 |
|
タンパク質の修飾
タンパク質は、リン酸化を代表に様々な修飾 modification を受ける。以下の表で整理しておく。文献 1 を参考にしているが、実例にはこのサイトで解説しているタンパク質が多く含まれる。
重要なことは、多くの場合
| 修飾 | ドナーおよび実例など |
|---|---|
リン酸化 |
ATP がドナーになる。 水酸基 -OH をもつ Ser, Thr, Tyr がリン酸化の標的となる。リン酸化する酵素をキナーゼ kinase、脱リン酸化する酵素をホスファターゼ phosphatase という。 例: p53 は少なくとも 18 個のリン酸化サイトをもっている。 |
アセチル化 |
一般に アセチル CoA がドナーになり、 リジンアセチル化酵素 lysine acetyltransferase および リジン脱アセチル化酵素 lysine deacetylase によって可逆的にアセチル化されると考えられてきたが、反応性の高いアセチルリン酸やアセチル CoA は、非酵素的にリジンをアセチル化でき、こちらが主要であるとされている (5)。 哺乳類細胞を用いてアセチル化タンパク質を網羅的に同定するアセチローム解析が 2006 年に報告されている (Open access 論文)。この論文では 195 のアセチル化タンパク質が同定されており、 ミトコンドリアがバクテリア由来であることから、バクテリアのタンパク質アセチル化は詳細に研究されている (6)。とくに、アセチル CoA、アシル CoA などの代謝中間体を利用したアセチル化は、エネルギー状態による酵素活性制御のメカニズムとして興味深い。 例: Histone のアセチル化による転写制御が有名。 |
ミリストイル化 |
ミリストイル CoA がドナーになる。脂肪酸修飾によって、タンパク質が細胞膜近傍に局在するようになる。受容体を介したシグナル伝達に影響することが多い。 例: Src, BID など。 |
メチル化 |
Arg, Lys で起こる。 例: Histone. |
| Glycosylation |
Asp, Ser, Thr に対する短い糖鎖の付加。細胞膜 のタンパク質でよくみられる。 例: ABO blood group antigens. |
| ADP ribosylation |
NAD+ がドナーになる。RNA polymerase など。 |
水酸化 |
Pro 残基が水酸化される。 例: Collagen, HIF-1α, |
| ユビキチン化 |
多くのタンパク質で分解シグナルとして働く。E1, E2, E3 というタンパク質群の作用により、ユビキチンと結合する。 |
| Farnesylation | Farnesyl pyrophosphate がドナーになる。Ras (G-protein) など。 |
| γ-カルボキシル化 γ-carboxylation |
Bicarbonate (HCO3-) がドナーになる。Thrombin など。 |
| Sulfation | 3'-Phosphoadenosine-5'-phosphosulfate がドナーになる。Fibrinogen など。 |
広告
References
- Amazon link: ストライヤー生化学
: 使っているのは英語の 6 版ですが、日本語の 7 版を紹介しています。参考書のページ にレビューがあります。
- Amazon link: 水島 (訳) 2015a. イラストレイテッド細胞分子生物学 (リッピンコットシリーズ).
- By GYassineMrabetTalk✉このベクターイメージはInkscapeで作成されました. - 投稿者自身による作品, パブリック・ドメイン, Link
- Amazon link: ハーパー生化学 30版.
古園 2016a. バクテリアにおけるアシル化修飾タンパク質の網羅的解析アシローム解析から見えてきたこと. 化学と生物 54, 871-872.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
