生体のエネルギー通貨 ATP:
構造、代謝、GTP との違いなど
UBC/other_metabolites/nucleic_acid/atp
このページの最終更新日: 2025/11/23- 概要: ATP とは
- なぜ ATP を「エネルギー通貨」というのか?
- なぜ ATP は分子内にたくさんのエネルギーを蓄えられるのか?
- その他 ATP 関連事項
- ATP とタンパク質のリン酸化
- 数の話: 好気代謝・嫌気代謝でグルコース 1 分子から作られる ATP の数など
広告
概要: ATP とは
ATP (アデノシン三リン酸, adenosine triphosphate, 図, Public domain) は、生体のエネルギー通貨として使われる物質である。リン酸基が 2 個および 1 個になったものを ADP および AMP という。
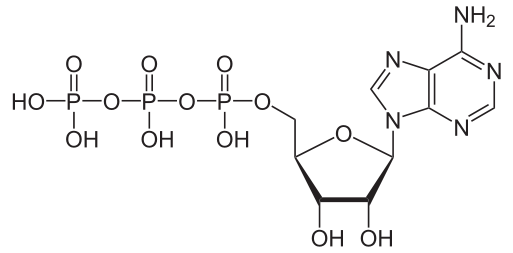
核酸の概要 のページにあるように
- ヌクレオシド nucleoside = ペントース + 塩基
- ヌクレオチド nucleotide = ペントース + 塩基 + 1 個以上のリン酸
- 核酸 = ポリヌクレオチド
であるので、ATP はヌクレオチドにあたる。構成要素はリボース ribose、塩基のアデノシン adenosine および 3 つのリン酸基 triphosphate unit である。
なぜ ATP は「エネルギー通貨」と言われるのか?
ATP のもつ自由エネルギー free energy が、その加水分解産物である ADP + Pi よりもかなり大きいためである (1)。
たとえば、グリセロール-3-リン酸がグリセロール glycerol と Pi に分解される時に放出されるエネルギーは 9.2 kJ/mol であるが、ATP が ADP と Pi になるときには 30.5 kJ/mol のエネルギーが放出される (1)。 これは、ATP よりも ADP, Pi がかなり安定なためである。その理由は以下の 3 つ。
- ADP と Pi は共鳴構造をとって安定化する。つまりエネルギー準位が構造から予測されるよりも低くなっている。
- ATP は 3 つ並んだリン酸基同士で電気的な反発がある。これが末端のリン酸基の解離に伴って解き放たれる。縮んでいるバネのようなイメージ。
- ATP, ADP, Pi とも水和により安定化するが、構造的に ATP がもっとも水和されにくい。
ところで、ATP よりもリン酸基の解離に伴う自由エネルギーが大きい = phosphoryl group を手放しやすい物質が生体内に存在する (1)。このような物質は、逆に ADP から ATP を合成することができる。
加水分解されるときに放出されるエネルギーを、高い順に以下の表にまとめる。
分子 |
説明 | エネルギー |
ホスホエノールピルビン酸 |
解糖系 glycolysis は グルコース を ピルビン酸 に変換する過程で 2 分子の ATP を生み出す。その反応が、PEP および下の 1,3-BPG から ADP へのリン酸基の転移である。 これは、両分子からリン酸基が解離する際に放出される自由エネルギーが、ATP からのリン酸基脱離に伴うそれよりも高いために起こる反応である。 |
-61.9 kJ/mol (3) |
カルバモイルリン酸 |
尿素回路 の中間体。 |
-51.4 kJ/mol (3) |
1,3-ビスホスホグリセリン酸 (1,3-BPG) |
PEP と同じく、解糖系の中間体である。 |
-49.3 kJ/mol (3) |
クレアチンリン酸 |
クレアチン creatine がリン酸化されたクレアチンリン酸は高エネルギー分子。 筋肉や脳 brain における ATP 再生のメカニズムである。 |
-43.1 kJ/mol (3) |
|
ATP → AMP + PPi |
ATP が AMP になるときには 32.2、ADP になるときには 30.5 kJ のエネルギーが放出される。 無機ビスリン酸 PPi の加水分解エネルギーは-19.2 kJ/mol である (3)。 |
-32.2 & -30.5 kJ/mol (3) |
|
その他 |
|
なぜ ATP は分子内にたくさんのエネルギーを蓄えられるのか?
3 つのリン酸基の間の反発力と、共鳴構造 (4)。更新予定。

その他 ATP 関連事項
ATP は、細胞内で Mg2+ や Mn2+ と結合しており、これが active form (1)。
リン酸基が外れるときに得られる自由エネルギーは他のものでも同じだが、ATP が最も使われる。しかし、アデニンでなく他の塩基が結合したヌクレオチドもエネルギー通貨として使われることがある (1)。GTP - GDP - GMP, UTP - UDP - UMP, CTP - CDP - CMP など。
Diphosphate をリン酸化する酵素を nucleotide diphosphate kinase という。NDP + Pi → NTP。
補酵素 NAD+ や FAD は ATP の誘導体である (1)。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
ATP とタンパク質のリン酸化
ATP は細胞のエネルギー通貨である以外に、タンパク質 protein がリン酸化修飾 phosphorylation される際にリン酸基を供与するという役割もある。これによって、細胞のエネルギー状態と代謝調節がリンクされている。
ここでは、リン酸化、リン酸化酵素 kinase、脱リン酸化酵素 phosphatase についてまとめる (1)。適切なページを作ったら、適宜内容を移動する。
- Kinase は ATP の末端のリン酸基を基質につけかえる。Phosphatase はリン酸基を外すが、それは ADP に戻るわけではなく、遊離の無機リン酸 Pi, orthophosphate になる。
- タンパク質に付加されたリン酸基は、2 価の negative charge を与える。これは構造変化の原因となる。
- リン酸化されるのは、一般に細胞内のタンパク質である。ATP や kinase が細胞内にあるため。細胞外タンパク質は proteolytic cleavage などによって活性を制御されている。
広告
References
Berg et al. 2006a. (Book) . Biochemistry, 6th edition.
|
Berg, Tymoczko, Stryer の編集による生化学の教科書。 巻末の index 以外で約 1000 ページ。 正統派の教科書という感じで、基礎的な知識がややトップダウン的に網羅されている。その反面、個々の現象や分子に対して生理的な意義があまり述べられておらず、構造に偏っていて化学的要素が強い。この点、イラストレイテッド ハーパー・生化学 30版 英語圏ならば学部教育向けにはややレベルが高い印象。しかし、基本を外さずに専門分野以外のことを |
- ページ編集に伴い削除
- Amazon link: ストライヤー生化学
: 使っているのは英語の 6 版ですが、日本語の 7 版を紹介しています。参考書のページ にレビューがあります。
- Amazon link: ハーパー生化学 30版.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
