転写を制御する DNA 結合タンパク質 ヒストン:
種類、修飾、アセチル化など
UBC/protein_gene/h/histone
このページの最終更新日: 2025/11/23- 概要: ヒストンとは
- ヒストンのアイソフォーム
- ヒストンの修飾
- アセチル化
- メチル化
- リン酸化
- ユビキチン化
- その他
広告
概要: ヒストンとは
ヒストン histone は核 nucleus の中で DNA に結合しているタンパク質である (1)。クロマチンのなかで、ほぼ DNA と同じ質量を占める。
クロマチンは
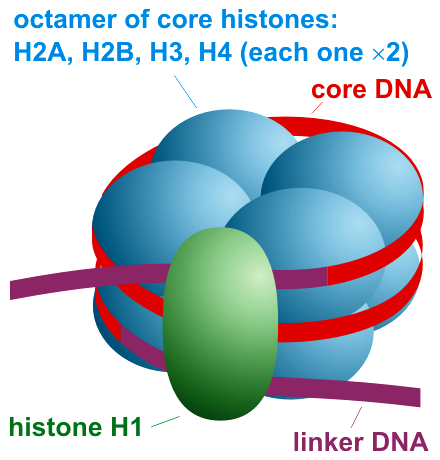
146 bp の DNA がヌクレオソームに結合しており、50 - 70 bp のリンカー DNA がリンカーヒストンである H1 に結合している。
ヒストンの役割 (ヌクレオソームの役割と考えても良い) は、主に以下の 2 点である (1)。
- DNA を核にコンパクトに格納する。
- DNA を状況に応じてほどくことで、遺伝子の発現を調節する。
以上のヒストンの機能は、ヒストンの修飾によって制御されている。ページ下方を参照のこと。
ヒストンのアイソフォーム
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
ヒストンの修飾
アセチル化、メチル化、リン酸化、ユビキチン化およびその他に分類されている (3)。一般に、DNA と結合する tail 領域が就職されることが多いようである (図, Ref. 5)。
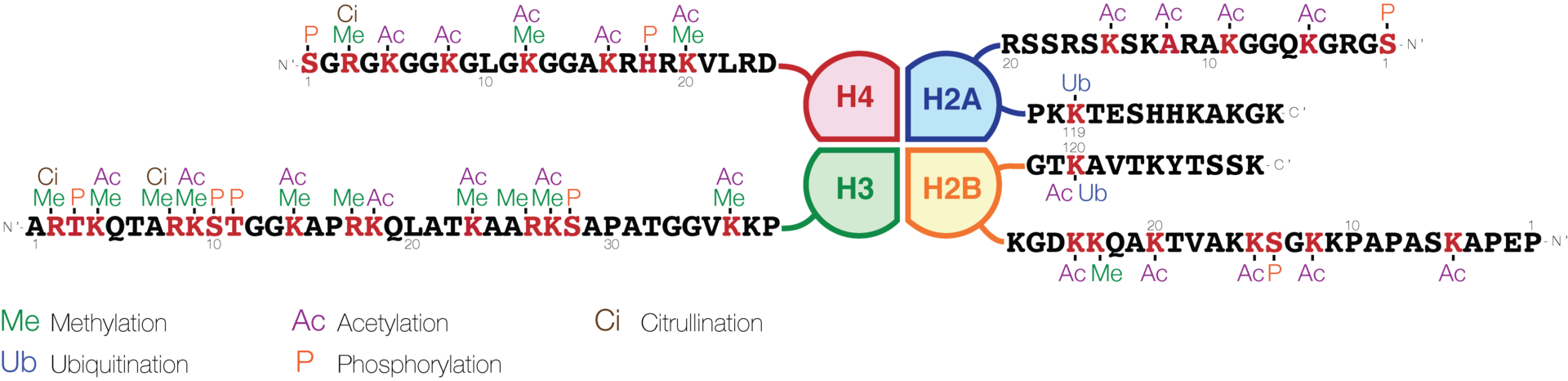
ヒストンのアセチル化
ヒストンはリジン lysine 残基でアセチル化され、
したがって、histone acetyl transferate (
ヒストンのメチル化
ヒストンのメチル化は、塩基性アミノ酸である アルギニン、リジン、ヒスチジン 全てに起こりうる。ヒストンのメチル化は、メチル化されるヒストンの種類および残基の位置によって以下のように表現される。
- ヒストン H3 の Lys 4 の場合、H3K4。ジメチル化の場合は、さらに H3K4me2 のように書く。me2, me3 は多数報告がある。
- よく研究されているリジンのメチル化は、H3K9, H3K27, H3K36, H3K79, H4K20 である (3)。
- アルギニンの場合は、H3R2, H3R8, H3R17, HR26 (3)。
- ヒストン H3 に関する知見が多いが、他のアイソフォームもメチル化修飾を受けることが最近明らかになっており、機能の解明が待たれる (3)。
一般に、ヒストンのメチル化は epigenetic reprogramming によって消去されると考えられている (3)。しかし、C. elegans と粘菌 Dictyostelium discoideum で、ヒストンのメチル化が次の世代に伝わる例があるようである (3)。
広告
References
- Amazon link: 水島 (訳) 2015a. イラストレイテッド細胞分子生物学 (リッピンコットシリーズ).
- By Darekk2 - Own work, CC BY-SA 3.0, Link.
Greer and Shi 2012a Histone methylation: a dynamic mark in health, disease and inheritance. Nat Rev Genet 13, 343-357.- Amazon link: Pierce 2016. Genetics: A Conceptual Approach
: 使っているのは 5 版ですが、6 版を紹介しています。
- By <a href="//commons.wikimedia.org/wiki/User:Mariuswalter" title="User:Mariuswalter">Mariuswalter</a> - <span class="int-own-work" lang="en">Own work</span>, CC BY-SA 4.0, Link
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
