酵素とは: 生化学的な解説
UBC/other_topics/biochem_basic/enzyme
このページの最終更新日: 2025/11/23リンクは別のページに飛びます。このページにも簡単な解説があります。
- 概要: 酵素とは
- 酵素活性の単位
- 酵素番号 (EC 番号)
- 酵素の構造
- 酵素反応論
- Michaelis-Menten
- Lineweaver-Burk plot
- 酵素活性の制御
- 関連トピック: こうじ酵素は効くのか?
広告
概要: 酵素とは
酵素 enzyme とは
酵素の作用を受けて変化する物質を
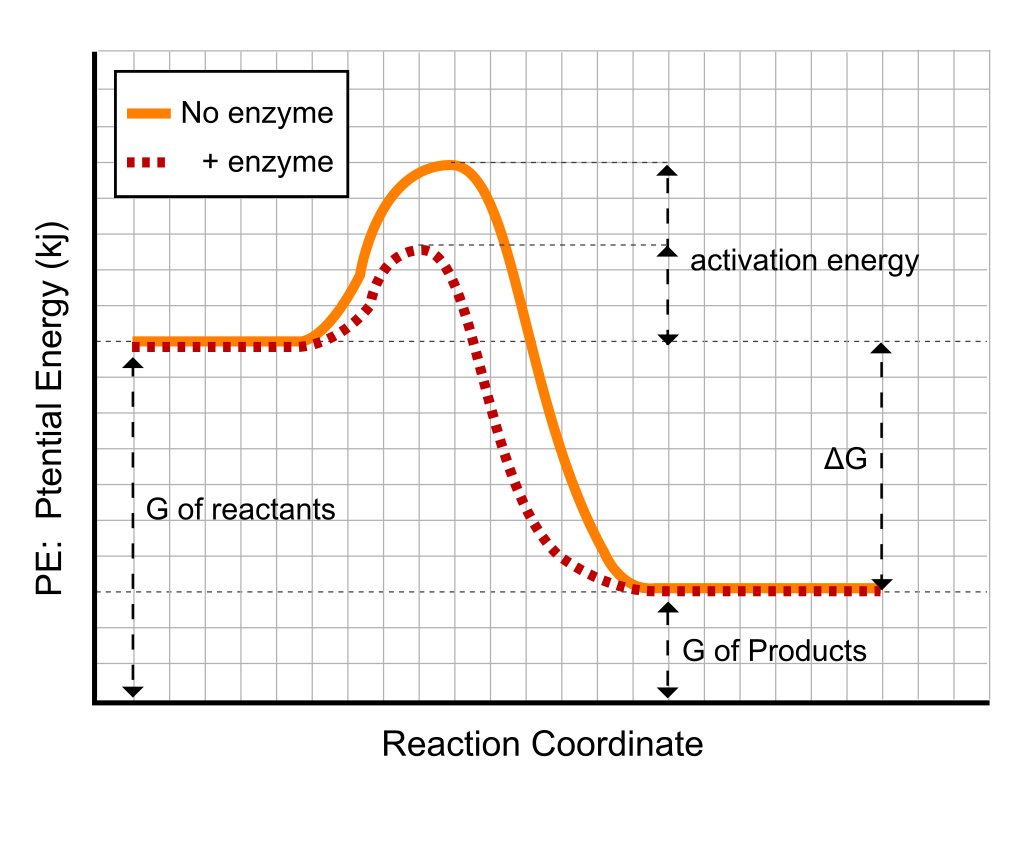
酵素によって通常は高いエネルギーを要求する反応が、温和な条件でかつ速やかに進む。このような
酵素活性の単位
酵素の触媒能力は、単位時間当たりにどれだけの量の基質を変換することができるかという値で表される。
酵素溶液が入ったチューブを考えてみよう。チューブ内の酵素が、5 µmol の基質を 1 分間で他の物質に変えることができれば、
しかし、これでは溶液量や酵素の濃度が変わった場合に比較ができない。酵素の量で enzymatic activity を補正した値を
この説明を読むと、酵素活性という値にはあまり意味を感じず、比活性のみが重要であるように思われる。この用語の使い分けは、純粋な酵素を得ることが実験的に難しいことに由来する。生体から酵素を精製するとき、どうしても他のタンパク質の混入が起こってしまう。したがって、実験的に得られる値は「酵素活性」であり、精製物の純度が上がるほど比活性に近づいていくが、実際には純粋な比活性に到達することはできない。
酵素番号 (EC 番号)
酵素番号とは、触媒する反応の種類に応じて酵素に割り振られる EC 1.1.1.1 のような番号である。
最初の数字がもっとも大きな区分けを示しており、例えば EC 1.x.x.x という酵素は全て酸化還元反応を触媒する酵素になる。この桁には 1 から 6 までの数字が割り振られている。つまり、全ての酵素反応は、以下の 6 種類のいずれかであると言える。
- Oxidoreductase: 酸化還元反応を触媒
- Transferase: 原子団をある分子から別の分子へ転移する
- Hydrolase: 加水分解反応を触媒
- Lyase : 脱離反応によって二重結合を生成する
- Isomerase: 異性体を作る
- Ligase : ATP の加水分解エネルギーを利用して、2つの分子を結合させる
酵素番号のページ に詳細とリストがある。
酵素の構造
酵素の構造は種類によって様々であるが、いくつか基本的な役割分担が存在する。
基質結合部位
酵素は原則として基質と結合する部位をもっている。一般に、基質結合部位は疎水性の高い (つまりタンパク質表面に位置しない) ポケットである (3)。
この結合の特異性は高く、よく「鍵と鍵穴の関係」に例えられる。右の図 (4) は、ヘキソキナーゼ という酵素と基質の結合を示した図である。
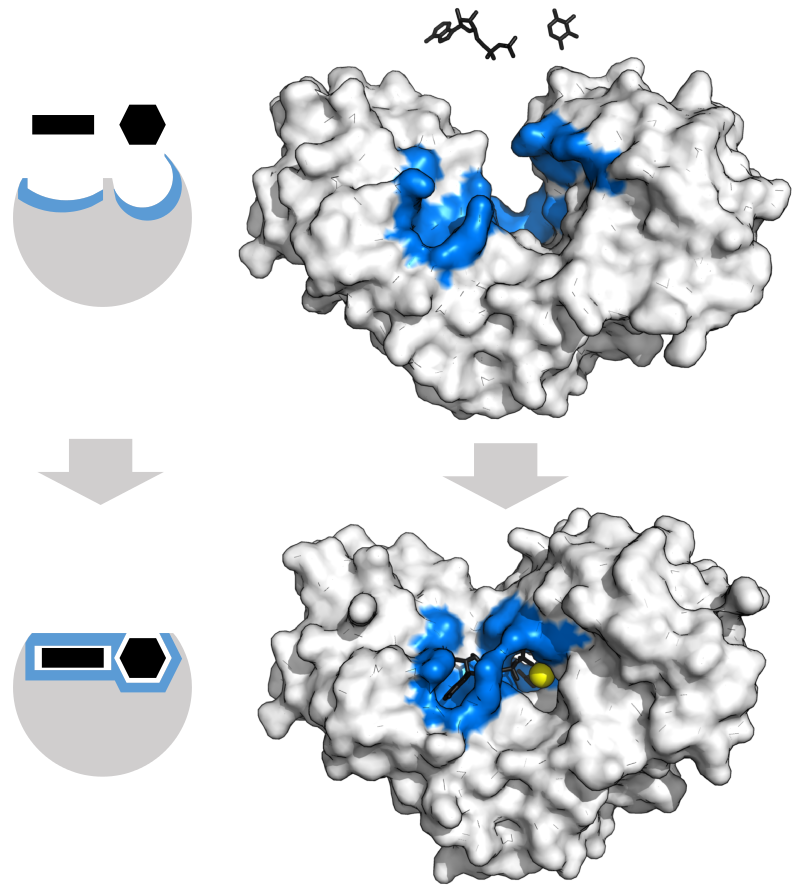
ただし、酵素は鍵穴のように硬いものではなく、たとえば基質が結合することによって構造が変化したりする。この柔軟性 flexibility も重要である。
活性部位 (触媒官能基)
以下のようなアミノ酸が、実際に触媒作用を発揮する。
| アミノ酸 | 官能基 | 実例など |
|---|---|---|
| His | イミダゾール基 | 生理的 pH で H+ を授受できることが特徴。
|
| Ser | ヒドロキシ基 |
側鎖に -OH 基をもつアミノ酸である。ここから水素が引き抜かれた O- は反応性が高く、二重結合を求核攻撃できる。ゆえに Ser はしばしば酵素の
|
| カルボキシル基 | ||
| Tyr | フェノール基 | |
| Cys | チオール基 | |
| Lys | アミノ基 |
酵素が高い触媒活性をもつ理由は、これらの官能基と基質の相互作用が密であることである。
分子配向制御 : 触媒官能基と基質の反応点がきわめて近傍に存在する。協同触媒効果 : 複数の触媒官能基が共同して作用する。反応場制御 : 酵素の他の部分などが、触媒に最適な環境を作り出すように作用している。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
酵素反応論
酵素反応ではない通常の触媒反応では、基質 (S) と触媒は溶液内で自由に動き回っており、両者がたまたま適切なぶつかり方をして、活性化自由エネルギーの山を越えるのに十分なエネルギーを得たときにのみ反応が進む (3)。これを式で表すと
となる。P は product で、反応生成物を示す。
ところが、酵素反応の場合には
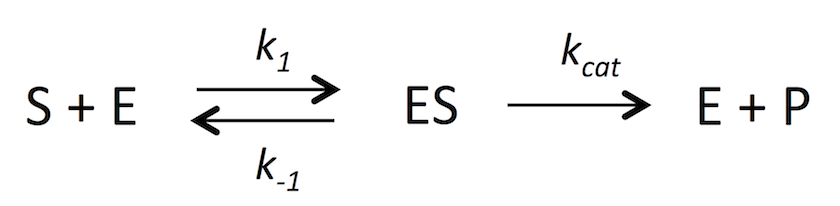
となる。
基質の濃度 [S] と P が生成する速度 dC/dt には一定の関係があり、両者の関係を表した
酵素活性の制御
以下の 5 つのパターンに分類される (5)。
| 制御 | コメント |
|---|---|
| アロステリック制御 |
Active site 以外の部位に物質が結合することによる制御。 実例: ATCase |
Isozyme の存在による制御 |
組織ごとに異なる酵素が発現する、などして活性を制御。 実例: SOD, LDH |
酵素の修飾による制御 |
リン酸化、アセチル化など。一般に、修飾は可逆的である。 実例: PDH |
Proteolytic aleavage |
酵素の一部を切断されると活性型になる。切断前の不活性型の酵素を zymogen または proenzyme という。 この反応は不可逆で、 実例: 消化酵素、凝結の制御、インスリン、collagen, caspase |
| 酵素量の調節 | 転写、翻訳、分解レベルでの制御。おそらく全ての酵素がこの制御を受けている。 |
広告
References
- Amazon link: 岩波 理化学辞典 第5版.
- Amazon link: A Dictionary of Biology (Oxford Quick Reference).
- Amazon link:
小宮山、長棟 1997a (Book). 生命化学概論 (基礎化学コース). 丸善株式会社. - "Hexokinase induced fit" by Thomas Shafee - Own work. Licensed under CC BY-SA 4.0 via Commons.
- Amazon link: ストライヤー生化学
: 使っているのは英語の 6 版ですが、日本語の 7 版を紹介しています。参考書のページ にレビューがあります。
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
このページには、以下のコメントを頂いていました。ちょっと意味はよくわかりませんが、ありがとうございました。
2018/05/08 13:16 説明的な事項の[E]0 とあらわることもある。
2018/05/08 13:15 誤字です。説明的な事項
