解糖系の律速酵素 ホスホフルクトキナーゼ PFK:
構造、機能など
UBC/protein_gene/p/pfk
このページの最終更新日: 2025/11/23広告
概要: PFK とは
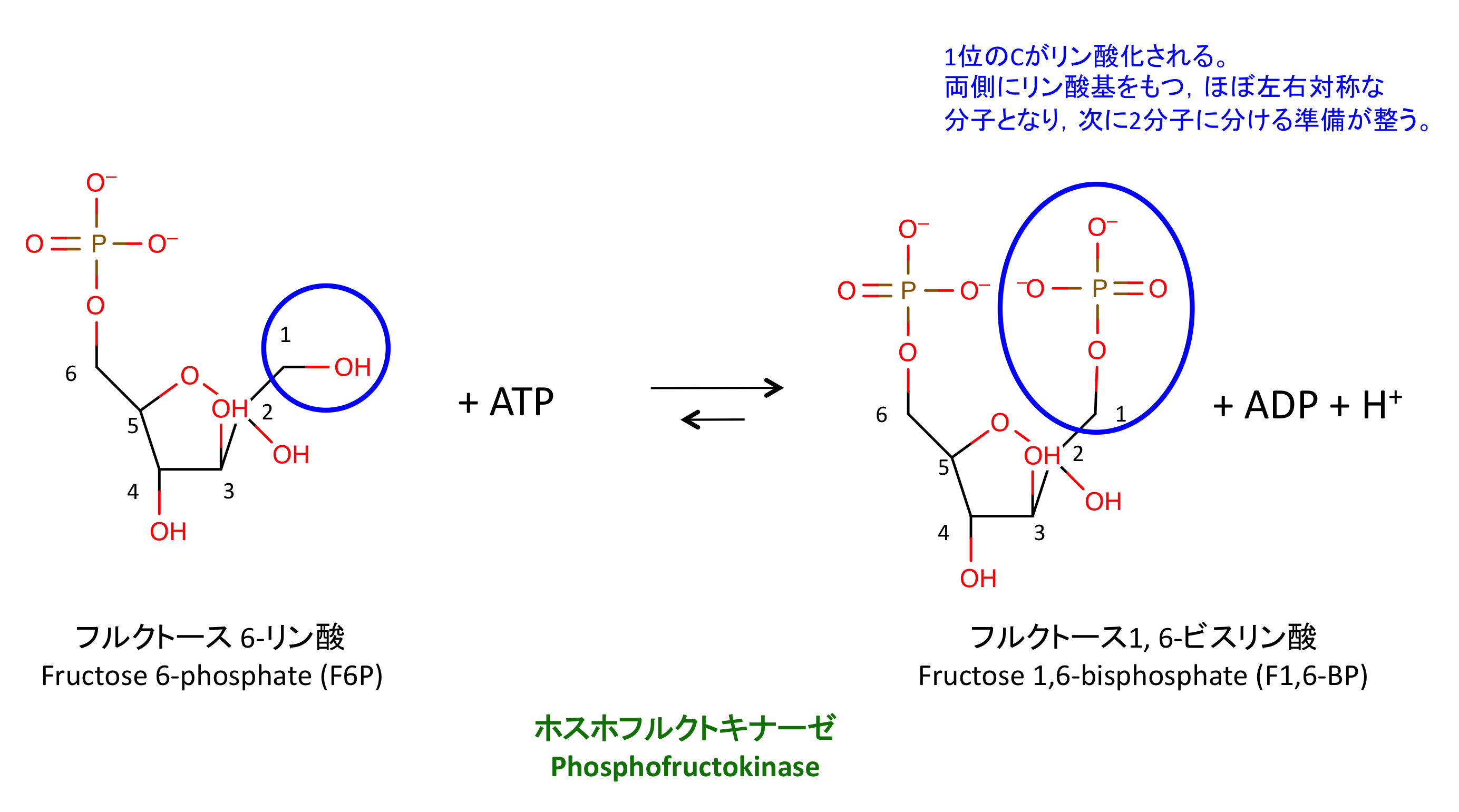
ホスホフルクトキナーゼ (PFK, phosphofructokinase) は解糖系 glycolysis の第 3 段階の反応を触媒する酵素である。フルクトース6-リン酸 から フルクトース1,6-二リン酸を合成する。
これは解糖系の不可逆反応の一つであり、PFK は
PFK のアイソフォームと構造
ヒトの PFK には PFK1 および PFK2 がある。以下に述べるように PFK2 は構造、機能ともに大きく PFK1 と異なる。
単に PFK という場合には、PFK1 のことを示す。PFK1 にはさらに組織特的なアイソフォームがある。
PFK1
ヒトの PFK1 には筋肉 muscle、肝臓 liver、血小板 platelet 型の 3 つがあり、それぞれ PFKM, PFKL, PFKP と呼ばれる (1I)。 PFKP は、繊維芽細胞 fibroblast タイプとみなされて PFKF と呼ばれることもある (2I)。また、齧歯類では P ではなく C-type という言葉が使われる。
> 組織分布は完全に exclusive なわけではなく、複雑である (2I)。
- 哺乳類 では、成体の筋肉は M-type のみを発現する。
- 哺乳類では、成体の肝臓は主に L-type を発現する。
- 哺乳類では、その他の組織は M, L, P タイプを全て発現、ホモダイマーとヘテロダイマーが混在する。
PFK は 4 量体として機能する (1I)。下の表は、ヒト PKFP の重要なアミノ酸残基。
| アミノ酸 | 機能 | 文献 |
| Arg48 | PFK に結合しているリン酸イオン PO43- と相互作用し、R48C mutant は citrate による阻害を受けにくくなる。しかし、ATP および F6P に対する作用は変わらない。 |
1 |
| Asn426 | Catalytic interface の近くに存在し、N426S mutant は ATP による疎外を受けにくくなる。 |
1 |
| Asp564 | Arg319 と電気的相互作用をし、D564N mutant は F6P との親和性や酵素反応速度が低下する。 |
1 |
PFK2
PFK 2 は、kinase domain と phosphatase domain が含まれる奇妙なタンパク質である (3)。構造は図の通り (4)。
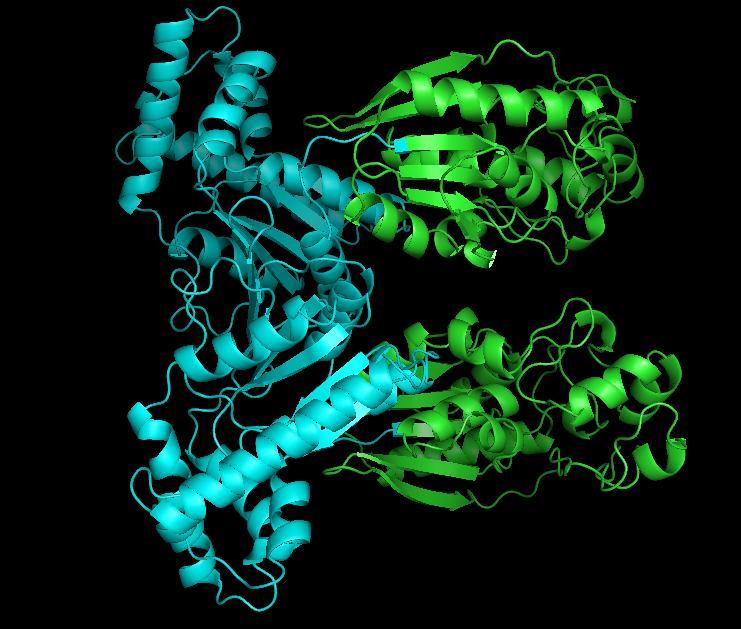
シアンで示される kinase domain は、解糖系の中間体である F6P をリン酸化し、fructose-2,6-bisphosphate (F-2,6-BP) を作り出す。緑の phosphatase domain は F-2,6-BP を脱リン酸化し、F6P に戻す。
このアイソフォームは
- PFK1 は F6P を 1 位でリン酸化するが、PFK2 は 2 位でリン酸化する。
- cAMP - PKA システムは PFK1 を活性化し、PFK2 を抑制する。ゆえに cAMP 量が少ないほど F-2,6BP の比率が高くなる。
- F-2,6-BP は PFK1 を活性化し、解糖フラックスを増大させる。ネガティブフィードバックであり、F-2,6-BP が一定量以上増えないようになっている。
- cAMP 量が増えると PFK2 が抑制され、解糖に回されるグルコースの割合が増える。
- cAMP 量が増えるような状況 (恐怖、興奮など) では、F-2,6-BP からも解糖系の基質が供給されることになる。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
PFK の活性制御
PFK が触媒する反応は、解糖系の律速段階として様々な分子による調節を受ける。筋肉では、エネルギー産生の制御を目的とした方向の変化を示すが、肝臓ではさらに複雑である (3)。解糖には、さまざまな生体分子を合成するための carbon skeleton を供給するという役割もあるため、肝臓ではこれに応じた制御も受けている。
PFK を活性化するもの
ADP |
筋肉では ADP および AMP で活性化 (3)。ATP で阻害される。 これの意味するところは分かりやすい。つまり ATP が少なくなると、解糖を促進してこれを作り出そうとする。 |
|
上記の PFK1 および PFK2 の説明を参照。 また cAMP はグリコーゲン合成酵素 glycogen synthase を阻害する作用ももっている。したがって、グリコーゲン合成ではなくグルコースの分解が促進されることになる。 |
|
F-1,6-BP |
PFKM は micromolar level の F1,6-BP によって活性化される。F1,6-BP は反応生成物であるため、これによってポジティブフィードバックループが作られることになる。 |
PFK を阻害するもの
ATP |
筋肉では ADP および AMP で活性化 (3)。ATP で阻害される。 |
プロトン |
PFK の至適 pH は 7.2 - 7.8 である (5)。筋肉の pH が低下すると PFK の活性も大きく低下する (3) が、実際には ATP 濃度は通常時の約 70% (約 3.5 mM) と、それほど低下していないようである。ミオシンや筋小胞体の ATPase のミカエリス定数はそれぞれ 0.1 mM および 0.06 mM と十分に低いので、ATP 濃度が 70% ほどになっても、実際の筋収縮には影響はないと考えられる。pH が低下するような状況では、PFK を活性化する AMP, IMP, Pi が増加し、pH の影響を相殺すると考えられている。 したがって、これはプロトンによる積極的な PFK 活性阻害というよりは、pH による構造変化の結果と考えるのが良いのだろうか。 肝臓では、運動によって乳酸が生成するという状態はないと書かれている (3)。生理的にプロトンによる制御がないだけなのか、PFKL がプロトン感受性がないのか? |
クエン酸 |
これは、TCA 回路 からのフィードバック阻害と考えてよさそうである。つまり、クエン酸量が多いということは TCA 回路によるエネルギー産生が盛んということで、解糖系の活性を抑えてグリコーゲンを作るという状況。 関連して、遊離脂肪酸によるグルコースの取り込み阻害という理論がある。
|
PFK の変異と病気
垂井病
グリコーゲン glycogen 分解に関連する酵素の異常によって、組織にグリコーゲンが多量に蓄積する病気を一般に 糖原病 glycogen storage disease という。複数のタイプがあるが、タイプ 7 が PFK の変異によるもので、とくに 垂井病 Tarui disease と名前がつけられている。筋力の低下、溶血などを伴う。
がん
一般に、ガン細胞 は十分な酸素がある状態でも解糖系が亢進している (ワーバーグ効果 Warburg effect)。 この現象に、解糖系の律速酵素である PFK が様々な形で関わっている。
多くのガンで、PFK1 の活性が高いこと、PFKP の発現が増大していることなどが報告されている (1D)。また少なくとも 44 の変異がガン組織から発見されている (1)。
PFK ノックアウトマウス
> PFKM KO mice は、トリアシルグリセロール 量が低下する (2)。
- グリセロール部分の供給が不足するためと考えている。
- この マウス は distal promoter に tag 配列が挿入されており、PFKM の発現が大幅に低下している。
- このマウスから単離された脂肪細胞では、脂肪合成は通常の約 40% であった。脂肪分解も低下していた。
- 解糖系の中間体 DHAP は、TG 合成の際、グリセロールを経て TG の glycerol component になる。
- 脂肪細胞の糖代謝の律速段階は、GLUT4 によるグルコース取り込みであると考えられている。
- したがって、PFKM の影響が大きいというこの論文の結果は意外であった。
広告
References
Webb et al. 2015a. Structures of human phosphofructokinase-1 and atomic basis of cancer-associated mutations. Nature 523, 111-114.Getty-Kaushik et al. 2010a. Mice deficient in phosphofructokinase-M have greatly reduced fat stores. Obesity 18, 434-440.Berg et al. 2006a. (Book) . Biochemistry, 6th edition.
|
Berg, Tymoczko, Stryer の編集による生化学の教科書。 巻末の index 以外で約 1000 ページ。 正統派の教科書という感じで、基礎的な知識がややトップダウン的に網羅されている。その反面、個々の現象や分子に対して生理的な意義があまり述べられておらず、構造に偏っていて化学的要素が強い。この点、イラストレイテッド ハーパー・生化学 30版 英語圏ならば学部教育向けにはややレベルが高い印象。しかし、基本を外さずに専門分野以外のことを |
- By Hyunsuky - Own work, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=10364749
和田ら、2006a. 筋収縮における乳酸の役割. 体育学研究 51, 229-239.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
