タンパク質濃度測定・ブラッドフォード法:
原理、プロトコールなど
UBC/experiments/protein/concentration_bradford
このページの最終更新日: 2025/11/23広告
概要: Bradford 法とは
Bradford 法は、SDS-PAGE 後の染色に使われる青い色素 Coomassie Brilliant Blue (CBB) と タンパク質 の結合を応用したタンパク質濃度測定法である。
CBB には、CBB G-250 と CBB R-250 の 2 種類があり、以下のように構造がわずかに異なっている (Ref 3, 4)。右上から 2 番目の炭素環にメチル基がついているのが G-250 で、こちらが Bradford 法に使われる。
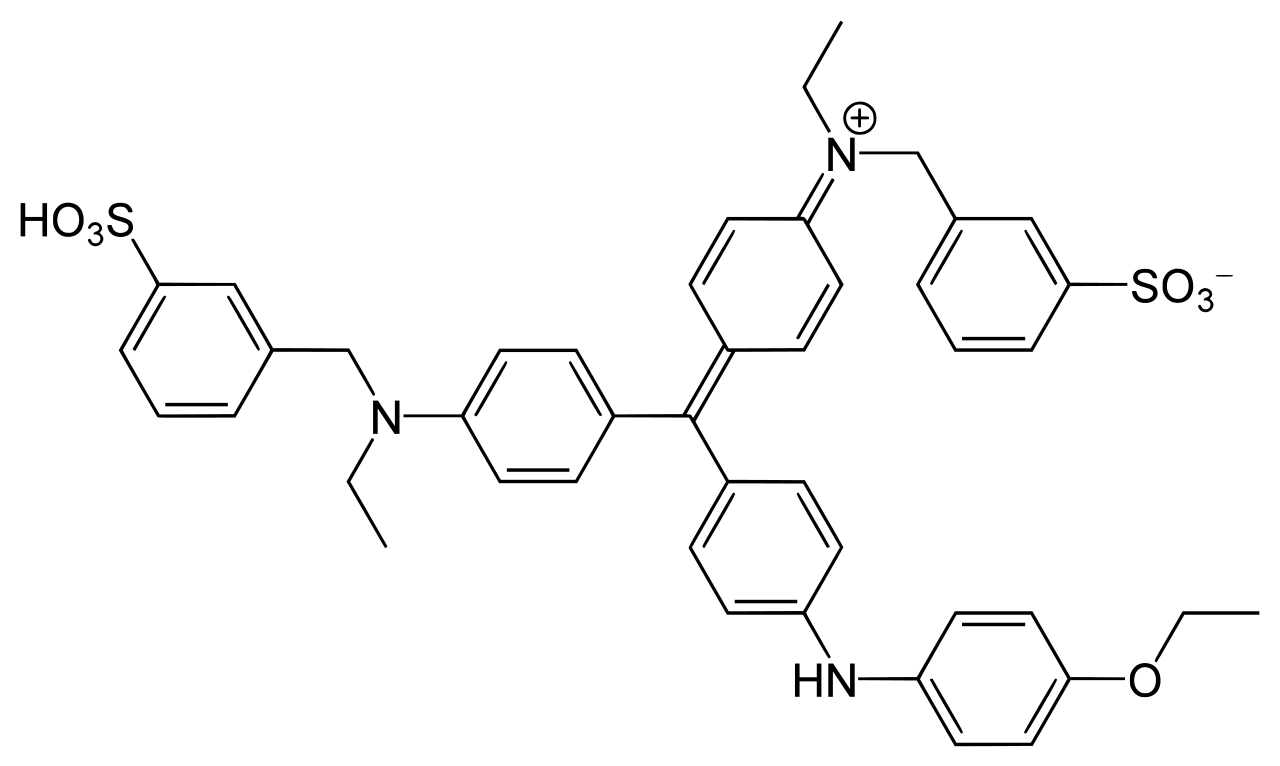
CBB R-250
|
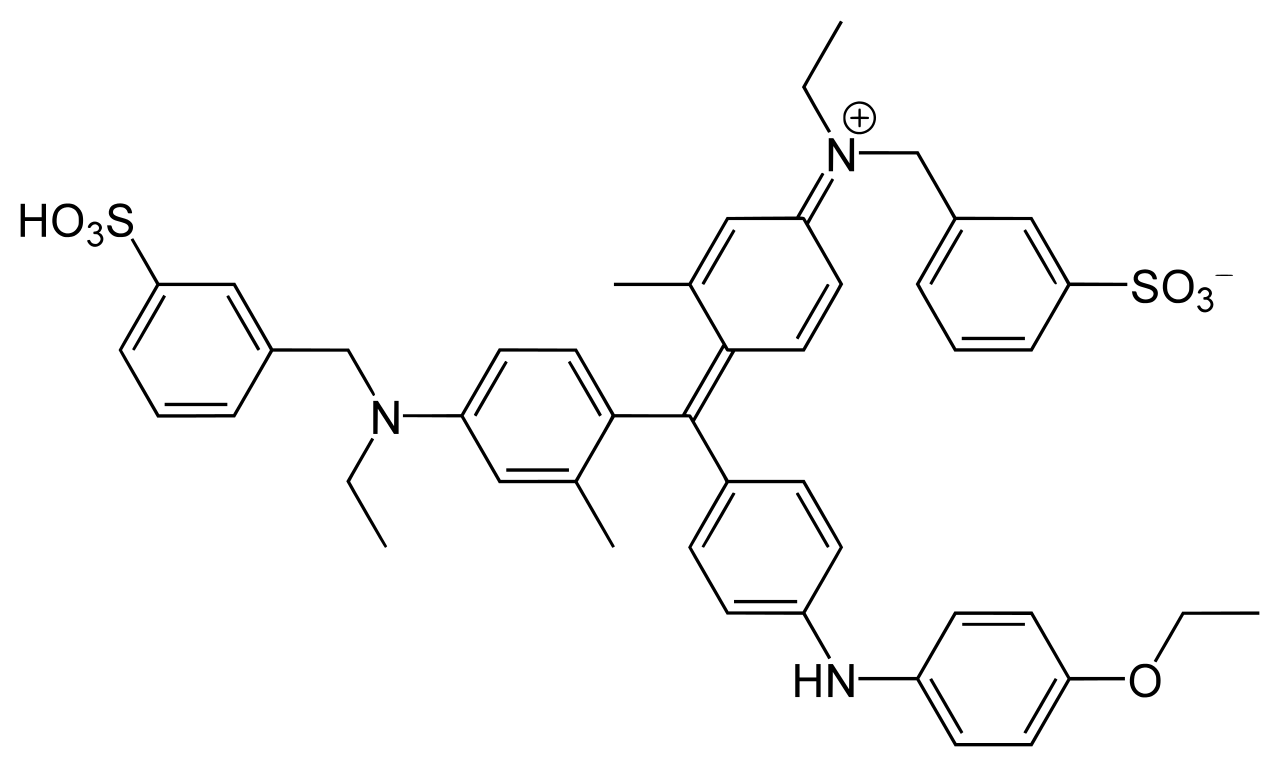
CBB G-250
|
CBB G-250 は、酸性条件下において、以下のようにタンパク質構成アミノ酸と結合する (2)。
- 塩基性アミノ酸 (アルギニン、ヒスチジン、リジン) と静電的相互作用をする。
- N 末端にあるアミノ酸と静電的相互作用をする。
- 芳香族アミノ酸 (チロシン、トリプトファン、フェニルアラニン) と疎水性相互作用をする。
この相互作用によって、CBB G-250 の極大吸収波長が 465 nm から 595 nm にシフトする (2)。色の変化でいうと、赤紫色から青色である。595 nm の吸光度を測定することで、タンパク質量を定量するのが Bradford 法である。
定量範囲は 10 – 2,000 µg/mL であり、280 nm 法よりも高感度である。
Bradford 法の長所と短所
Bradford 法には、以下のような特徴がある (2)。
長所
- 280 nm 法ほどではないが簡単である。タンパク質溶液と混合し、室温で 1 分間静置するだけで測定可能になる (2)。
- 還元剤 (DTT、メルカプトエタノールなど) およびキレート剤に影響を受けない (2)。BCA 法および Lowry 法はこれらに影響される。
短所
界面活性剤の影響が大きい 。ただし、最近ではこの短所を克服したキットも販売されている。
Bradford 法のプロトコール
大体はキットになっているので、そのマニュアルを参照のこと。ここでは、一般的な内容のみをまとめておく。多くの場合、Bradford 法によるタンパク質の定量は、以下のような手順を踏む。
- 付属の標準液を使って、検量線用のサンプルを作成する。
- 検量線用のサンプルと、濃度を測定したいサンプルに Bradford 液を加えてちょっと待つ。最近のキットは 1 分 - 1 時間ぐらいの間で呈色具合が変わらないようになっているので、事実上待ち時間はない。
- 595 nm の吸光度を測定する。
- 検量線から導いた式を使って、タンパク質量を算出する。
他の測定法でも、この手順は大体同じである。検量線用のサンプルを作るところが手間なので、これが不要の 280 nm 法はかなり簡便と言える。
1. 検量線用のサンプルを作る
0 から 2000 µg/mL ぐらいの範囲で、検量線用のサンプルを作成する。ここで重要なのは、
概要 で述べたように、Bradford 試薬が結合するのは塩基性アミノ酸であるアルギニン、ヒスチジン、リジンと、芳香族アミノ酸であるチロシン、トリプトファン、フェニルアラニン。さらに N 末端のアミノ酸である。
したがって、これらのアミノ酸がタンパク質にどれくらい含まれているかによって、計算されるタンパク質量が変わってくる。厳密な濃度測定をするには、サンプルと同じアミノ酸組成のタンパク質を使って検量線を作る必要がある (事実上、不可能に近い)。
以下の 2 種類のタンパク質がよく使われる。
牛ガンマグロブリン |
Bovine gamma globulin。組織から抽出したタンパク質を定量するときは、一般にこちらを用いる。 |
牛血清アルブミン |
Bovine serum albumin。BGG よりも発色が強い。アルブミンを多く含む 血液 サンプルの場合は、BSA で検量線を作ることが推奨される。 |
例として行った実験では、ページ下の 4. タンパク質濃度を算出する の表にあるように、0 - 1500 µg の範囲で 8 点をとっている。少なくとも N = 2 で行うことが推奨される。
2. Bradford 液を加える
Bradford 液の添加量は重要でなく、吸光度を測定する機器によって決める。
1 mL などの大きいキュベットしかない場合には、全体の液量が 1 mL 必要である。100 µL のキュベットや、プレートでの測定ができるなら、それに応じて液量を減らすことができる。
検量線用のサンプルと、濃度を測定したいサンプルに Bradford 液を加える。
正確に定量するためには、サンプルの濃度は、検量線の範囲内でなければならない。サンプルが濃いようなら、希釈する必要がある。
3. 595 nm の吸光度を測定する
595 nm が吸収極大であるが、560 nm から 610 nm の範囲なら正確な定量が可能という資料も (参考)。
4. タンパク質濃度を算出する
あまり綺麗な検量線ではなく恥ずかしいのだが、やってみた結果を載せておく (Public domain)。
検量線用のサンプルは、2 個ずつ作製した。平均値をとって検量線を作る。機器の測定の精度やダイナミックレンジによって、原点を通る直線にならない場合もある。これを近似的に直線で示しているケースは多いと思うので、切片 = 0 にはしなくて良いはず。
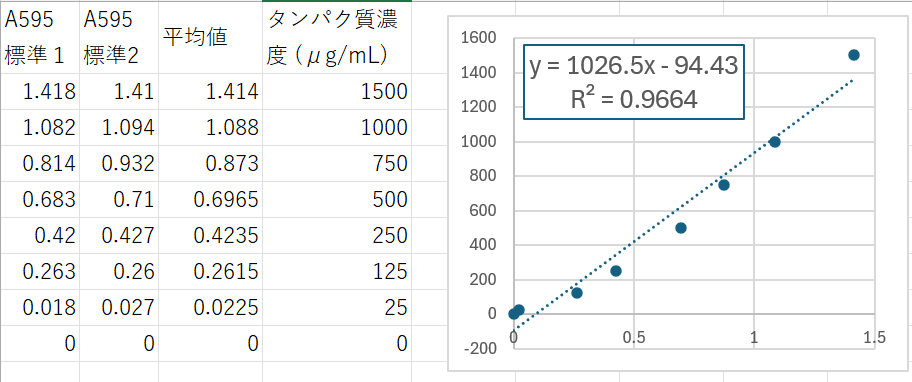
この例で、たとえばタンパク質サンプルの吸光度が 0.57 だったとしたら、その濃度は
1026.5 * 0.57 - 94.43 = 490 µg/mL
と計算される。もし、タンパク質サンプルの 5 倍希釈液を使って実験したのなら、実際の濃度はさらにその 5 倍で 2453 µg/mL である。
広告
References
- Amazon link: Molecular Cloning: A Laboratory Manual, Fourth Edition
Cold Spring Harbor Laboratory Press.
鈴木 2018a (Review). 総タンパク質の定量法. ぶんせき.- By --Phillsox - selfmade by using Chemsketch 10.0 and Inkscape, Copyrighted free use, Link
- By Yikrazuul - Own work, Public Domain, Link
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
