リン酸カリウム緩衝液: 作り方、組成、pH の範囲など
参考ページ
緩衝液 (バッファー) については、次のページが参考になると思います。1 - 6 が基本です。この順にどうぞ。
広告
概要: リン酸カリウム緩衝液とは
溶液中に H2PO4- と HPO42- が存在すると、両者の間でプロトン H+ の授受が起こるため、溶液の pH が変化しにくいという
リン酸カリウム緩衝液は、カリウム塩を使って作ったリン酸の緩衝液である。リン酸イオンは生体にも高濃度で含まれているので、緩衝液に使っても影響が少ないという利点がある。
例えば酸を加えた場合、HPO42- が H+ と結合して H2PO4- となるため、H+ の濃度である pH は変化しない。
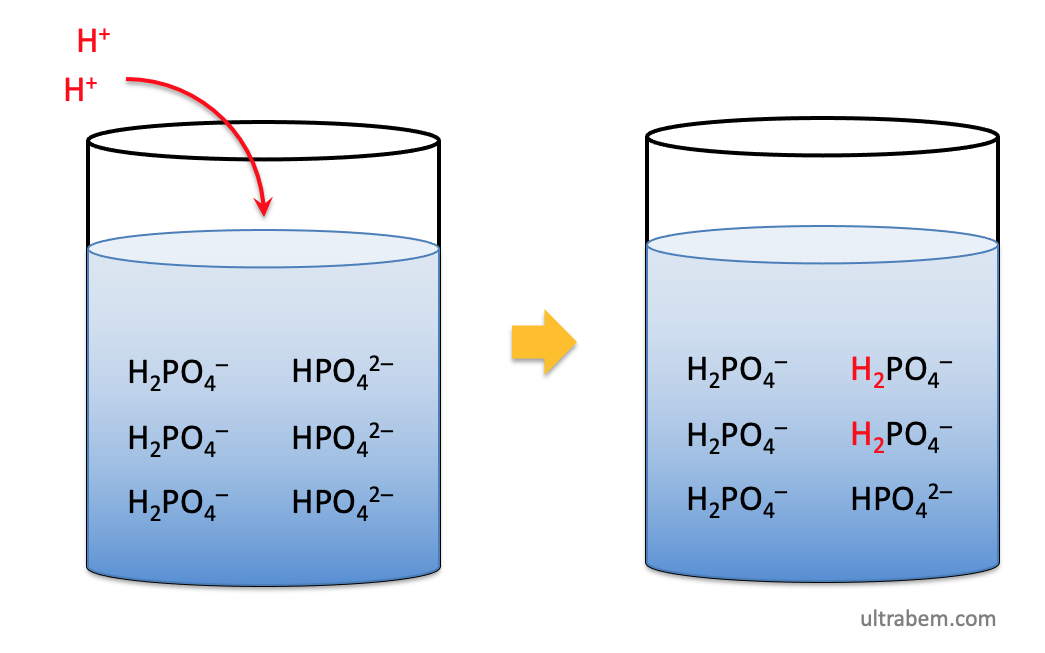
同様に、この溶液にアルカリを加えた場合、H2PO4- から H+ が供給され、水 が生成する。この場合も pH は変化しない。
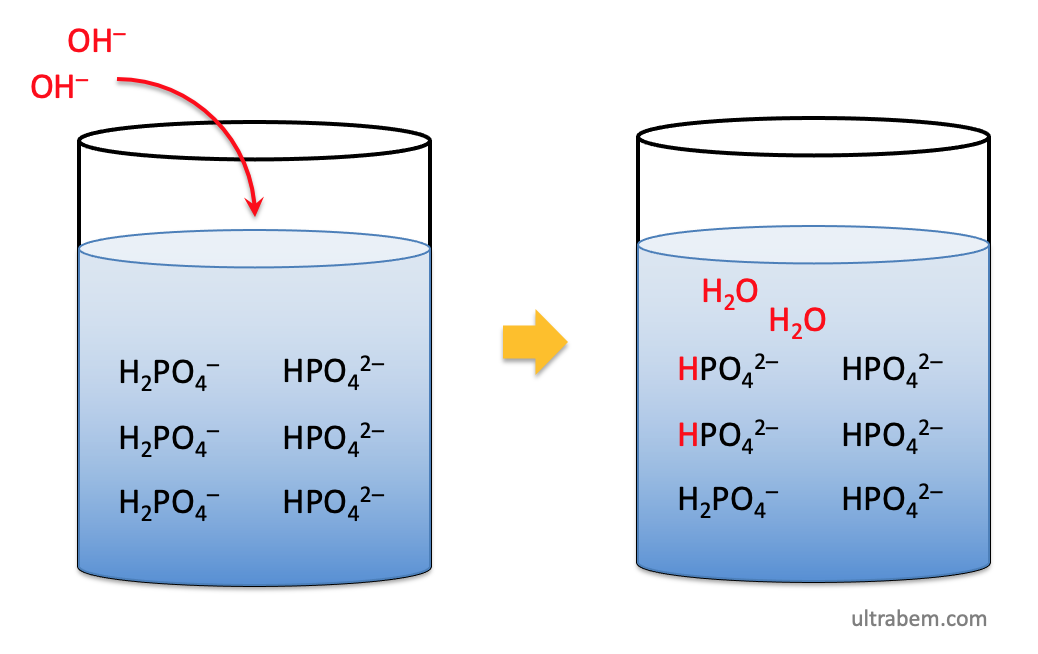
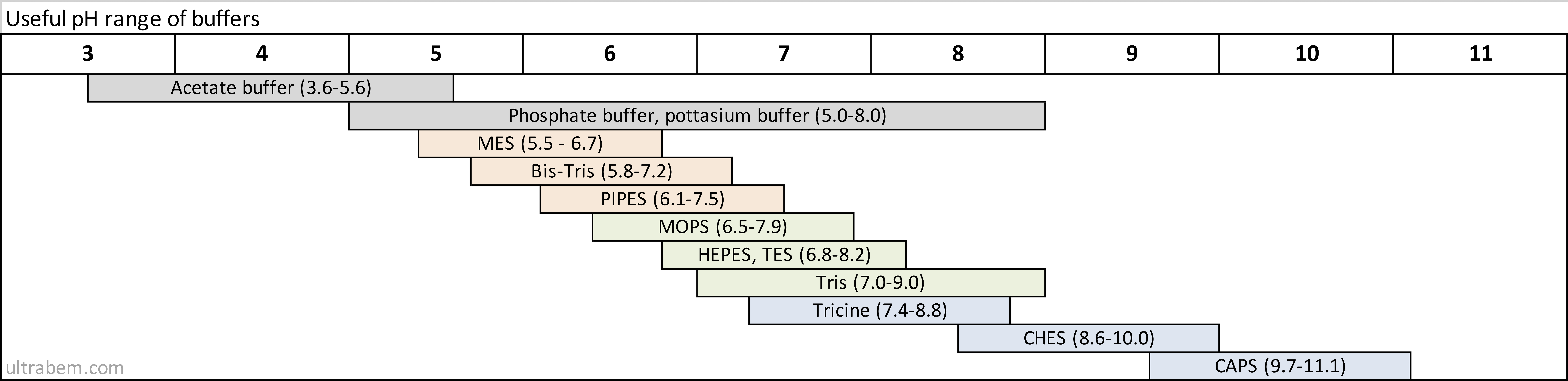
もちろん、緩衝能を超える量の H+ や OH- が加えられたときは、pH は変化してしまう。緩衝液には最適な緩衝の範囲がある。リン酸緩衝液は、一般に pH 5 - 8 で緩衝能が高いとされている。
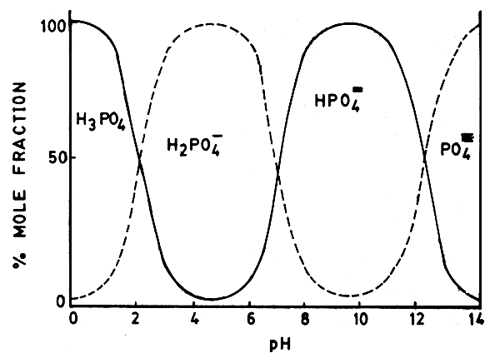
FAO より引用。pH によって、リン酸イオンがどう変化するかという図。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
リン酸カリウム緩衝液の作り方
100 mM のリン酸カリウム緩衝液 (pH 7) を例に作り方を示す。
100 mM のリン酸カリウム緩衝液を作る場合は、100 mM K2HPO4 溶液と 100 mM KH2PO4 溶液を用意し、pH を測りながら混合するのが一般的である。
K2HPO4 と KH2PO4 の 式量 formular weight は、それぞれ 174.18 および 136.09 である。したがって、プロトコールは以下のようになる。
- 1.74 g の K2HPO4 を 80 mL 程度の蒸留水にビーカーで溶かす。全て溶けたら、メスシリンダーを使って正確に 100 mL に合わせる。これが 100 mM K2HPO4。
- 1.36 g の KH2PO4 を 80 mL 程度の蒸留水にビーカーで溶かす。全て溶けたら、メスシリンダーを使って正確に 100 mL に合わせる。これが 100 mM KH2PO4。
- pH を測りながら、2 つの溶液を混ぜ合わせる。
- 100 mM のとき、経験上 K2HPO4 の pH は 9 ぐらい、KH2PO4 の pH は 5 ぐらいになる。配分を変えて、望みの pH にセットする。
広告
References
田村 (2014). 改訂版 バイオ試薬調製ポケットマニュアル.
一般的なバイオ実験に使われる試薬の作り方がまとまっているハンドブック。一冊手元にあると便利。サイズも実験の邪魔にならずお手頃。
2003 年にオリジナル版、2014 年に改訂版が出た。I 部は溶液・試薬データ編、II 部は基本操作編になっており、ピペット操作など実験の基本がイラスト付きで説明されている。研究室に入って 1-2 年目はとくに重宝するが、末永く使うことができるだろう。このページ に見開きサンプルあり 。
「緩衝液 その原理と選び方・作り方」という非常に特化した本がある。値段は高いが、大学レベルで生化学をやるなら、研究室に置いておいた方が良い本と言えるだろう。
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
