緩衝液 buffer について:
原理、選び方、性質、作り方など
UBC/biochemistry/buffer
このページの最終更新日: 2025/11/23酸・塩基と pKa に関連するページは、次の順に読むことをお勧めします。
- 質量作用の法則と平衡定数
- ルシャトリエの原理
- 酸と塩基の定義
- 水のイオン積と pH
- 解離定数
- このページ: 緩衝液について
このページの目次
- 概要: 緩衝液 buffer とは
- 緩衝液が pH を一定に保つ原理
- 緩衝液を選ぶ際に考慮すべきこと
- pKa と緩衝能
広告
概要: 緩衝液 buffer とは
多くの生物では、細胞や血液の pH は弱アルカリ性 (7.3 前後) に保たれている。そのため、たとえば 酵素 の活性を測りたい、タンパク質 を活性を保ったまま抽出したい、など、生理的な条件を守りたい場合には、これに近い pH 条件下で実験を行う必要がある (生理的条件という)。さらに、いろいろな試薬を加えても pH があまり変化しないことが望ましい。
このような実験の際に
緩衝液とは、弱酸とその共役塩基との混合溶液で、
このサイトには、たとえば以下のような buffer のページがある。完全なリストは 試薬の目次 のページを参照のこと。
|
「緩衝液 その原理と選び方・作り方」という非常に特化した本がある。値段は高いが、大学レベルで生化学をやるなら、研究室に置いておいた方が良い本と言えるだろう。
緩衝液が pH を一定に保つ原理
酢酸溶液を例にすると、pH が変わりにくい理由は以下のように説明される。酢酸 CH3COOH は、溶液中では CH3COO- および H+ に電離している。これを式で表すと
この反応の平衡定数 Ka は、
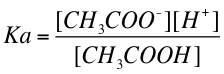
であり、この式を変形して 対数 をとると
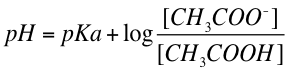
となる。なお、ここで対数をとっているのは、pKa が 0.000001 などと非常に小さい値になるためである。
したがって、
この式は Henderson-Hasselbalch equation として知られている。緩衝能に関係する別の表現を下に挙げておく。
- 緩衝液に酸を加えると、H+ は CH3COO- と反応して酢酸 CH3COOH を作る。そのため H+ 濃度である pH が変化しにくい。水に同じ量の酸を加えた場合、ほとんどの H+ は直接 pH の低下に寄与することになる。
- 溶液に塩基を加えると、OH- は H+ と結合して水分子を形成し、そのため pH は下がる。しかし緩衝液の場合、
平衡定数が一定になるように 減った分の H+ が酢酸から供給されるため、pH は下がりにくい。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
緩衝液を選ぶ際に考慮すべきこと
pKa と緩衝能
緩衝液の基本的な役割は、pH を一定に保つことである。どの pH にセットしたいかによって、使う緩衝液の種類を変えなければならない。
pH を一定に保とうとする作用を
以下の図を見てみよう。小さい場合はクリックで大きくなるはず。
その他の注意事項を簡単にまとめておく (2)。いずれアップデートする。
- 最終的に吸収スペクトルを調べる場合、緩衝液に余分な吸収がないこと。
- 実験中の pH の変化が最小であること。基本的には上記の緩衝能に近いが、例えば反応によって pH が変化するような系では、その変化まで考慮に入れる必要がある。
- クエン酸バッファーはカルシウムイオンをキレートするので、カルシウムを使う実験系には適さない。また、酸素に対するイオン強度の効果を測定するときには、金属イオンを含まない緩衝液を使う。このように、特定の実験系との相性があるので気をつける。
広告
References
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。

