ルシャトリエの原理
UBC/other_topics/biochem_basic/le_chatelier
このページの最終更新日: 2025/11/23- 概要: ルシャトリエの原理とは
- ルシャトリエの原理について具体的に
- 温度の変化
- 圧力の変化
- 濃度の変化
- ルシャトリエの原理を「平衡定数一定」の規則から理解する
以下の一連のページが、酸・塩基についてのまとめになっています。体系的に学びたい人は、以下の順に読むことをお勧めします。
- 質量作用の法則と平衡定数
- ルシャトリエの原理 (このページ)
- 酸・塩基の定義
- 水のイオン積と pH
- 解離定数
- 緩衝液 buffer について
広告
概要: ルシャトリエの原理とは
化学反応 aA + bB + ... ⇌ cC + dD + ... が平衡 equilibrium に達したとき、各成分の濃度の比 K
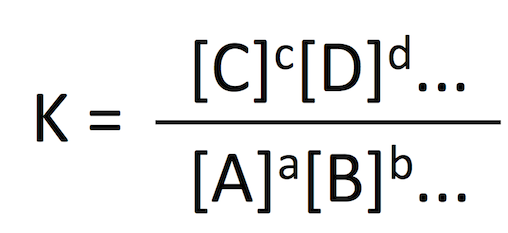
は
これを
平衡定数は温度と圧力のみの関数であるから、定温・定圧では一定の値をとる。このページでは、条件が変わった際の平衡移動を支配する
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
ルシャトリエの原理について具体的に
化学平衡状態にある系の温度や圧力などを変化させると、系は新しい平衡状態へ向かって変化する。この平衡状態の
|
平衡にある系の熱力学変数の一つに変化を与えると、その変化により生ずる影響をなるべく小さくする方向に平衡の移動が起こる (3)。 |
温度、圧力および濃度について、具体例で考えてみる。
温度の変化
窒素 と 水素 を反応させると、以下の反応式のように アンモニア と熱が生じる。
N2 + 3 H2 ⇌ 2 NH3 + 92 kJ
この反応系の温度を下げると、温度低下をなるべく小さくする方向、すなわち反応から熱が出る方向へ平衡が移動する。
右向きの反応が起こって、新しい平衡状態に達すると言っても良い。したがって、この反応から得られるアンモニアの量は、温度を下げることで増える。
圧力の変化
同じ反応で、左辺には右辺の 2 倍のモル数の気体がある。つまり窒素を 1 とすると水素は 3、生成するアンモニアは 2 である。
圧力を上げると容積は小さくなる。平衡は容積変化を打ち消す方向に移動するので、右側へ移動することになる。
濃度の変化
同じ反応で、生成するアンモニアを取り除いたとしよう。このとき、平衡はアンモニアを増やす方向に移動する。つまり右へ移動する。
一方、反応から窒素を取り除いた場合には、この窒素の不足分を補うために平衡は左に移動することになる。
ルシャトリエの原理を「平衡定数一定」の規則から理解する
下の反応系に N2 を添加した場合について、シンプルに考えてみる。
N2 + 3 H2 ⇌ 2 NH3 + 92 kJ
- 上の反応が平衡状態にあるときに N2 を添加すると、N2 の濃度が上がり、平衡が崩れる。
- 平衡定数 K の定義から、N2 の濃度は分母にくる。したがって、N2 添加直後には K が小さくなる。
- ところが、K は一定でなければならないので、平衡は K を大きくして元の値に戻す方向に移動しなければならない。
- K を大きくするためには、分子の値 (すなわち NH3 の濃度) を増やさなければならない。
- したがって、平衡は右に移動することになる。「変化を打ち消す方向」と同じことになる。
文献 4 には数式を使った説明が載っているので、そちらも参照のこと。ただし、これはルシャトリエの原理を限定的にしか説明できないので、あまり好きではない。
どういうことかというと、ルシャトリエの原理は温度が変化したときにも成り立つ。温度が変化すると平衡定数も変わるので、「平衡定数が一定だからルシャトリエの原理が成り立つ」という説明は通用しない。
広告
References
- Amazon link: 岩波 理化学辞典 第5版
: 使っているのは 4 版ですが 5 版を紹介しています。
- 平衡定数の単位について. Link.
- Amazon link: 平尾, 加藤 1988a. 化学の基礎 分子論的アプローチ
- 哲猫. 化学平衡. 高2理系化学夏期講習テキスト 2009. Pdf file: Last access 2018/01/24.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
