解離定数 Dissociation constant:
定義、意味、単位など
UBC/biochemistry/dissociation_constant
このページの最終更新日: 2025/11/23- 概要: 解離定数とは
- 解離定数の単位
- 酸と塩基の解離定数 pKa
- pKa が低いほど強い酸である
- pKa は、その酸が半分だけ解離するときの pH である
- Henderson-Hasselbalch の式
- 平衡移動と pKa
- pKa の実験的求め方
- Advanced: pKa は溶媒によって変わる
広告
概要: 解離定数とは
化学反応 aA + bB + ... ⇌ cC + dD + ... が平衡 equilibrium に達したとき、各成分の濃度の比 K を以下の式のように定義すると、
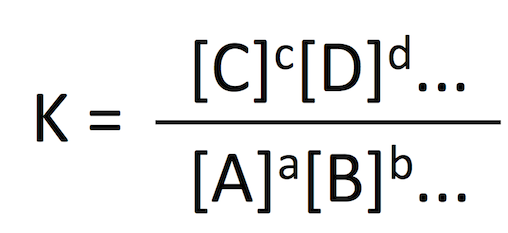
この法則を 質量作用の法則 law of mass action という (1)。K は
解離定数 dissociation constant は平衡定数の一種であり、対象とする化学反応が解離 dissociation (= 可逆的な分解) の場合の名称である。したがって、解離定数も温度と圧力のみに依存する関数である。
理化学辞典 (4) では、解離定数は次のように定義されている。
|
物質がその成分原子、イオン、原子団などに可逆的に分解する反応をいう。一般に高温ほど分解が進む傾向があり、 加熱による解離を熱解離という。また水溶液中などで電解質がイオンに解離する場合をとくにイオン解離または電離という。解離反応の平衡状態 (解離平衡) に対して質量作用の法則が適用され、その平衡定数をとくに解離定数という。 また解離平衡において解離している分子数の全分子数に対する割合を解離度という。電離に対する解離定数、解離度をそれぞれ電離定数、電離度ということがある. |
解離定数の単位
平衡定数は本来は無次元の数であり、単位は存在しない。しかし、濃度を使った上の式は実は近似式であり、この場合は反応の種類によって濃度に関係した単位をもつことになる。
質量作用の法則 law of mass function のページで、平衡定数の単位について述べてある。上の式の近くにあるリンクからどうぞ。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
酸と塩基の解離定数 pKa
この項目は、酸と塩基についての一連のトピックの一部でもあります。体系的に調べたい人は、以下のような順番で読むことをお勧めします。
- 質量作用の法則と平衡定数
- ルシャトリエの原理
- 酸・塩基の定義
- 水のイオン積と pH
- 解離定数 (このページ)
- 緩衝液 buffer について
上記の解離反応が、H+ を放出する反応であるとき、その解離定数をとくに
Ka 解離定数であるので、その式自体に特別なところはない。しかし、pKa は生理的に大きな意味をもっている値なので、ここで詳しく解説する。
例として COOH をもつ脂肪酸 fatty acid が解離して、H+ を放出する反応を考えよう。このとき、Ka および pKa は以下のように定義される (5)。
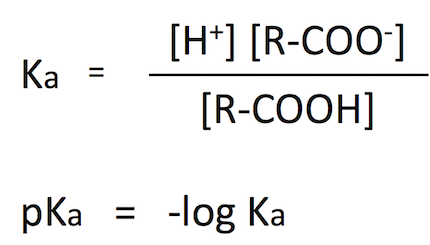
pKa と Ka の関係は、[H+] に対する pH の関係と同じである。pKa に関する生化学的に重要なポイントは以下の通り。
- 強酸では、水溶液中のすべての分子が解離していると考えることが多い。この場合には分母が 0 になってしまうので、
強酸の pKa は定義できない 。 - しかし実際には 100% の分子が解離していることはありえず、岩波 理化学辞典 第5版
(Amazon) には「pKa < 3 のものをふつう強酸という」と書かれている。個人的には、強酸・強塩基という曖昧な概念は嫌いである。
以下、pKa の重要ポイントを解説する。
pKa が低いほど強い酸である
「強い酸」とは、解離の程度が高い酸、すなわち同じ濃度でたくさんの H+ を放出できる酸のこと。
解離度が高いということは、pKa の式において分子の値が大きく、分母の値が小さいということである。したがって Ka は大きくなる。pKa にはマイナス符号がついているので、pKa は小さくなる。代表的な酸の pKa を表にしてみる。
| 酸 | pKa | 特徴 |
塩酸 |
-8 | |
乳酸 |
3.86 | 文献 5 |
酢酸 |
4.76 | 文献 5 |
NH4+ |
9.25 | 文献 5。アンモニア NH3 はプロトンを受け取るので塩基だが、アンモニウムイオン NH4+ は酸である。 |
炭酸 |
pK1 = 6.37 |
文献 5 より。炭酸 carbonic acid は 2 価の酸なので、pKa も 2 つある。 |
リン酸 |
pK1 = 2.15 |
文献 5 より。 |
アミノ酸 |
1.8 - 13 と広い |
文献 5 より。 左サイドバーからアミノ酸の目次に行くと、それぞれの pKa の一覧がある。 |
pKa は、その酸が半分だけ解離するときの pH である
これは単純な式変形だ。
上の式で、半分だけ解離しているのだから [RCOO-] = [RCOOH] である。するとこれらがきれいに約分されて、
Ka = [H+]
よって
pKa = pH
この考え方は、等電点電気泳動などの際にも重要となる。
広告Henderson-Hasselbalch の式
弱酸 HA が
のように電離するとき、以下の
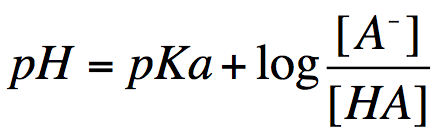
この式からは、様々なことがわかる (5)。
- pKa のポイントと同じく、弱酸のちょうど半分が電離しているとする。このとき [A-] = [HA] であることから、log の部分は 0 になり、つまり pH = pKa である。要するに、法則「pKa は、その酸が半分だけ解離するときの pH である」はこの式から導くことができる。
- [A-] と [HA] の比が 100 : 1 のとき、log の部分は 2 になる。よって pH = pKa + 2。
2 番のようにして解離度と溶液の pH をプロットしていくと、下の図のようになる (7)。ここで pKa は酸に固有の値で温度と圧力が変わらない限りは一定あること、pH は溶液の状態なので可変であることを思い出そう。
図は、例えば「酢酸の溶液に少しずつ塩酸を加えていって、pH と酢酸の電離度を調べた」ような場合を想定している。
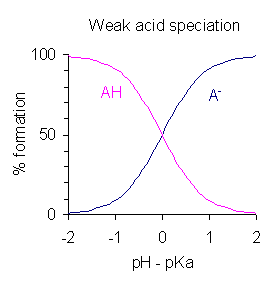
平衡移動と pKa: 酸の濃度が上がると解離度は下がる
このセクションでは、平衡、平衡移動の概念と pKa を繋げることを試みる。考える平衡は HA ⇌ H+ + A- であるが、具体例として酢酸の平衡を考える。下記の式の pKa は約 5 である。
まず、一定量の水に 1 g の酢酸を加えたら pH が 6 になったとする。これに、さらに 1 g の酢酸を加えたら pH が 5 になった。このとき、解離度や平衡にどのような変化が起こっているだろうか? 温度などの条件は一定とし、溶液は希薄溶液とする。
酢酸の pKa を 5 として考えると、温度・圧力一定の条件下では、この値は変わらない。
pH = 6 になったとき、Henderson-Hasselbach の式
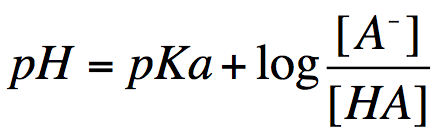
より log([A-]/[HA]) = 1 である。したがって ([A-]/[HA]) = 10 となり、[A-] = 10 x [HA] である。[HA] は加えた酢酸全体の濃度ではなく、「加えた酢酸のうち、電離していないものの濃度」であることに注意しよう。
この式において [HA] すなわち [CH3COOH] の 10 倍量の CH3COO- があるということになり、この平衡はかなり右によっているイメージになる。
さて、さらに酢酸 1 g を加えて pH = 5 になったとしよう。このとき、同様の計算によって [A-] = [HA] である。上で述べた pH = pKa = 5 の状態だ。pH = 6 の状態から考えると、CH3COOH の 10 倍量もあった CH3COO- が H+ と会合し、いまや CH3COOH と同じ量しかなくなってしまったということである。つまり、平衡が左に移動し、電離度が下がったと考えられる。
以上の結果は、「CH3COOH を加えたので、それを打ち消す方向に平衡が移動した (ルシャトリエの原理) 理解することもできる。このように、一般に
pKa の実験的求め方
pKa は、滴定実験から求めることができる。計算式は、文献 8 にわかりやすくまとめられていた。Henderson - Hasselbach の式を実際に使うことになる。
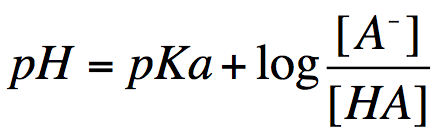
ある弱酸 HA を、強塩基の水酸化リチウム LiOH で滴定する実験を考える。すると、[A-] および [HA] は実験的に得られる以下のパラメーターを用いて表すことができる。すなわち、
- CH: 弱酸試料溶液の濃度
- VH: 弱酸試料溶液の体積
- COH: 滴下した LiOH 溶液の濃度
- VOH: 滴下した LiOH 溶液の体積
としたとき
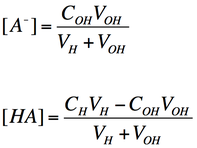
である。どちらの式も、分子の単位は濃度 x 体積 (つまり酸および塩基の量)、分母の単位が濃度であるので、全体としての単位は濃度になる。
なお、考える反応は
であり、いくつか重要な事項がこの立式に込められている。確認しておこう。
- LiOH は強塩基なので、完全に電離すると仮定している。よって Li+ + A- の濃度は等しくなる。
- HA は、ちょうど LiOH と釣り合う分だけ電離している。なぜならば、上の式でさらに HA が電離すると A- がさらに供給されることになり、平衡が左へ移動し、結局 HA に戻るためである。
- もし HA と LiOH が等量存在すると、HA は完全に電離することになる。なぜならば、HA が存在することで平衡が右に移動するためである。「滴定では弱酸の電離度は考慮しなくて良い」というルールの原理。
[A-] は Li+との濃度と等しく、最初の式で与えられることになる。分子は加えたアルカリの量、分母は溶液の全体量である。
[HA] は、もともとの酸の全体量から、加えたアルカリの量を引くことで求められる。加えたアルカリの分は、完全に電離していると考える。
式変形から
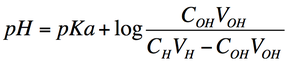
この式で、pKa 以外は全て滴定実験から得られるデータになる。縦軸に pH、横軸に log の値をプロットすると直線状のグラフとなり、その切片が pKa になる。
Advanced: pKa は溶媒によって変わる
このページは高校・大学初期レベルの内容をまとめているが、実際には、平衡定数は活量、反応ギブズエネルギーなどの概念を用いて熱力学的に定義される必要があるようだ。
上記の Henderson-Hasselbalch の式など説明は、希薄溶液に関する理論的なものである。
実際には pKa は溶媒 (溶媒のイオン強度) よって変わる (9)。これは平衡定数が温度と圧力のみの関数であることと矛盾しているように思える。これは、「平衡定数が一定」というのは無限希釈条件においてのみ通用するルールであるが、溶媒の変化はこの前提条件を取り払ってしまうためと解釈していいのだろうか。
広告
References
- 株式会社ファルマデザイン.Link.
- その相互作用は強いのか - 解離定数の判断基準. Pdf file.
- Amazon link: ストライヤー生化学
: 使っているのは英語の 6 版ですが、日本語の 7 版を紹介しています。参考書のページ にレビューがあります。
- Amazon link: 岩波 理化学辞典 第5版
: 使っているのは 4 版ですが 5 版を紹介しています。
- Amazon link: ハーパー生化学 30版.
- pKa とは? ヘンダーソン-ハッセルバルヒの式. Link.
- 由Petergans (talk) - A species distribution diagram as described in Martell, A.E.; Motekaitis, R.J. 1992. Determination and use of stability constants. Wiley. ISBN 0471188174. Section 2.4、公有领域、链接
瀧澤ら, 2015a. 一塩基酸の中和滴定曲線の解析と酸解離定数の測定:pHメーターを用いた無機分析実験の教材化. 新潟大学教育学部紀要 8, 117-122.和田 1975a. 非水溶液中の酸・延期の構造と強度. 有機合成化学 33, 809-820.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
