抗体を使ったタンパク質の定量実験 ウエスタンブロット:
原理、プロトコール、トラブルシュートなど
UBC/experiments/protein/western_blot
このページの最終更新日: 2025/11/23- 原理
- プロトコール
- SDS-PAGE
- メンブレンの選択
- トランスファー
- ブロッキング
- 抗体反応
- 検出
- Tips
- ウエスタンブロットの定量性
- 異なる抗体に由来するバンド
- トラブルシューティング
- シグナルが見えない
- 分子量のずれ
広告
原理
原理については多くの成書があるので詳述しない。主に Berg Biochemistry (Amazon) の説明から、簡単に記しておく。
- まず、タンパク質の電気泳動を行う。ほとんどの場合は SDS-PAGE であろう。この電気泳動では、タンパク質が分子質量 molecular mass に応じ分離される (移動距離は、分子質量の対数に比例して小さくなる)。
- 次に、ゲル内のタンパク質をメンブレンに転写する。
- メンブレン上のタンパク質を、抗体 を用いて検出する。
プロトコール
メンブレンの選択は、実験を開始する前にやっておくべきだろう。実際のプロトコールは、主に以下の 5 ステップから成る。
- SDS-PAGE によるタンパク質の分離
- メンブレンへの転写 (Transfer)
- ブロッキング (Blocking)
- 抗体反応
- 検出
SDS-PAGE
SDS-PAGE のページを参照。ここでは詳述しない。
メンブレンへの選択
ウエスタンブロットのメンブレンには、PVDF (ポリフッ化ビニリデン polyvinylidene difluoride) 膜とニトロセルロース膜がよく用いられる。両者の特徴は以下の通り。タンパク質の吸着力の高さから、PVDF 膜の方がよく用いられている (2)。
PVDF 膜の方がタンパク質の吸着力が高い 。- メタノールによる親水化は、PVDF 膜のみで行う。ニトロセルロース膜でやるとメンブレンが変になる。
- バックグラウンドはニトロセルロースの方が低くなる傾向にある。
なお、ナイロンメンブレンは 核酸 の転写によく用いられるが、ウエスタンブロットには普通は使わない。バックグラウンドが高いこと、メンブレンを染色できないことがその理由である (13)。
トランスファー
Transfer には、大きく分けて
- ウェット法
- セミドライ法
の 2 つがある。ウェット法の方が長い時間が掛かるが、大きいタンパク質の転写効率が高くなる。図はセミドライ法である。
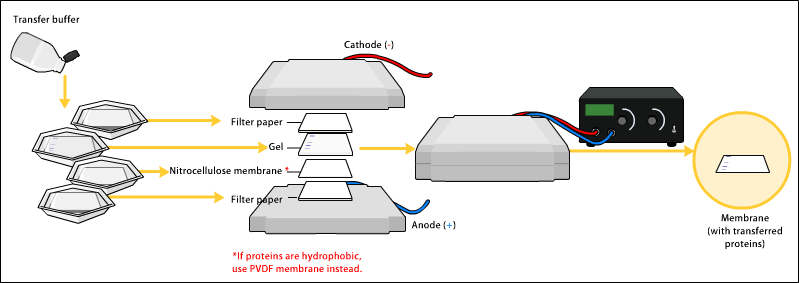
Transfer buffer の組成は様々である。例えば 25 mM Tris, 190 mM glycine, 20% methanol (9). pH 8.3, 80 kD よりも大きいタンパク質を転写するときは、0.1 % SDS を加えることを推奨すると書かれている。
> トランスファーバッファーのメタノールは、転写効率を上げる (16,17).
- アルコールはタンパク質から SDS を外す作用があり、メンブレンとの相互作用を強める。
- タンパク質は SDS と結合してゲル内に存在している。アルコールはゲルの pore size を小さくするため、大きいタンパク質の転写効率を下げる。
- 一方、SDS を加えるとゲルからタンパク質が離れやすくなるが、メンブレンへの結合は弱まる。トランスファーバッファーが SDS を含むときには、とくにアルコールが必要である。
ブロッキング
PDVF 膜やニトロセルロース膜は、タンパク質を吸着する。転写操作が終わった後では、SDS-PAGE されたタンパク質が膜に吸着しているが、膜にはタンパク質がついていない部分も多数残されている。
このような部分が残っていると、次のステップで膜と抗体をインキュベートするときに
通常、以下のようなタンパク質溶液が使われる。
スキムミルク |
安価であるが、主成分の一つであるカゼイン casein がリン酸化されているため、リン酸化抗体を使うウエスタンブロットでは使用できない。 Stripping してもバックグラウンドが出るので、将来的にリン酸化抗体でブロットする可能性のあるメンブレンには使わない方が無難。 5% skim milk/TBS、室温で 1 h または 4 °C O/N あたりが普通だと思う。なお、組織切片を使う 免疫染色 では、0.5% ぐらいに skim milk 濃度を落とすのが普通。 |
牛血清アルブミン |
リン酸化抗体を使うウエスタンではこちらを使う。高価なのが唯一の欠点。 |
豆乳 |
市販の豆乳が意外と良いことを報告した論文がある (15)。 |
抗体反応
標識した一次抗体を使う直接法と、標識なし一次抗体 + 標識二次抗体を使う間接法がある。
直接法では、プロトコールが簡単になるほか、二次抗体の非特異的反応による問題を減らすことができる。ただし、以下のようなデメリットも多い。
- 標識が抗原抗体反応に影響するかもしれない
- 一次抗体の特異性が低い場合、バックグラウンドが上がる
- 一次抗体は種類が実験に応じて種類がたくさん必要なので、その全てを標識するにはコストがかかる
これらのデメリットが、そのまま二次抗体を利用することのメリットとなる。これに加えて、蛍光標識などのさまざまな検出法を、二次抗体を変えるだけで利用できる。また、シグナルの増幅効果もあり、間接法がウエスタンブロットの主流になっている。
私が使っていたプロトコールでは、一次抗体反応は 4°C O/N が抗体が痛まないのでよいとされていた。室温で 1 時間ぐらいというプロトコールも可能である。
- 一次抗体の希釈率はマニュアルに従うが、予備的検討が必要な場合もある。
- 一時抗体液を節約するため、ビニール袋の中にメンブレンと一緒にパックする感じ。液がメンブレン表面に触れていれば十分。
- 洗浄は TBS で 5 min x 3 回とか。
二次抗体は安価で、希釈率も 10,000 倍とかなので、再利用はせずに直接タッパーの TBS に添加して使っていた。室温 1 時間など、wash は 10 min x 3 とか。
検出
わりとクラシックな ECL と X 線フィルムを使用していた。
- 2 つの ECL 液を混ぜ、メンブレンにかける。
- 余分な液を除き、ラップなどでフィルムに ECL 液が直接触れないようにする。
- 遮光状態で X 線フィルムとともにカセッテに入れ、5 分から O/N のインキュベート。
- 暗室で現像液により現像。
いくつか tips を書いておく。
- 発光は、試薬にもよるが数時間程度までしか続かない。30 min exposure とそれ以上では、あまり違いがないという意見もちらほら (18)。
- もう一度 ECL をやり直すときは、二次抗体処理からやり直すのが良さそう (18)。過酸化水素で酵素が失活するらしい。
試薬のテスト
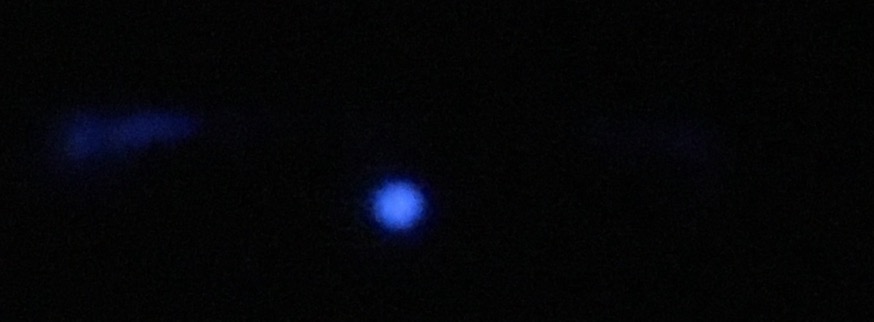
二次抗体、ECL および現像液が使えるかどうか、以下の方法で確かめたことがあった。試薬が古かったとき。ドットブロットの後半。
二次抗体 (Bio-Rad 製品、通常 10,000 倍で使用) を TBS で 500 倍に希釈し、1 µL をメンブレンに直接ブロットする。

これに ECL 液をかける。とくに高感度 ECL でない普通のものだけど、この量だと、発光が目に見えるぐらい光る。フィルムを使う必要がない。
さらに手抜きの方法もある。二次抗体を希釈せずに 0.5 µL をプロットし、plus とかでない普通の ECL をかける。これはスマホで写真が撮れるぐらい光る。
Tips
ウエスタンブロットの定量性
ウエスタンブロットは、しばしば「半定量的」な実験にすぎないとされることがある。転写、抗体反応、検出など実験のステップが多く、かつそれぞれのステップで飽和の可能性があることが主な理由である。
定量性を高めるためのポイントが GE ライフサイエンスのページ にまとめられている。
- 泳動ではポジコンで検量線を作れるようにしておく。
- 比較したいサンプルは同じゲルで泳動する。
- 場所によってメンブレンへの転写効率が違う可能性がある。
- モノクローナル抗体の方が望ましい。複数の認識部位をもつポリクロ抗体では、サンプル間のタンパク質の変性度合いによって定量性に差が出てしまうためと書かれている。しかし、これはモノクロでも似たようなものなのではないかと思う。
- ダイナミックレンジの広い蛍光標識二次抗体が望ましい。
- 抗体濃度の最適化も重要。過剰な抗体はバックグラウンドシグナルを高め、定量を困難にする。
- 検出は、X 線フィルムよりも CCD カメラまたは蛍光スキャナーの方がダイナミックレンジが広い。
異なる抗体に由来するバンド
標的タンパク質に対する親和性は抗体によって異なる。したがって、2 つの western blot でバンドが同程度だったとしても、それは標的タンパク質が同じくらいあることを意味しない。
ピルビン酸キナーゼ PK isoforms, PKM1 と PKM2 の比がガンの進行に伴って変化するという論文があるが (6)、Western blot での結果が、mass spectrometry によって覆されている (7)
トラブルシューティング
シグナルが見えない
シグナルが見えない場合、以下のような点をチェックする。
| 問題点 | 特徴、対処法など |
|---|---|
現像液 |
化学発光 (ECL) と X 線フィルムで検出している場合。現像液は古くなると黒っぽくなって使えなくなる。 |
検出試薬 |
試薬の有効期限などを確認。とくに 2 液を混ぜて使うタイプの ECL 試薬では、液が混ざってしまうと失活しやすくなるので注意。 |
二次抗体 |
二次抗体には、いくつか問題になりうる点がある。
|
一次抗体 |
一次抗体にも、いくつか問題になりうる点がある。
|
転写 |
タンパク質がちゃんとメンブレンに転写されているか? これは prestained protein size marker (染色せずにバンドが見えるもの) を使うことで簡単にチェックできる。 |
分子量のずれ
タンパク質の 分子量 はアミノ酸配列から計算することができるが、これは SDS-PAGE でのタンパク質の移動度と一致しない場合も多く、特異的なバンドであるかどうかの解釈は難しい。以下に、分子量がずれる一般的な原因と、その特徴を示す。ただし、基本的にはタンパク質の種類によって千差万別であるので、複数の実験の結果から総合的に判断する必要がある。
一般的には糖鎖の分だけ分子量が大きくなり、バンドは上にずれるが、糖鎖の組成によっては下にずれることもある。
糖鎖を除く酵素でタンパク質を処理して分子量が変化すれば、バンドシフトは (少なくとも一部は) 糖鎖修飾によるものであると言ってよいだろう。どのぐらい分子量が変化するかはタンパク質によって異なるが、40 kDa も変化した例も報告されている (4)。
- PNGase F (Glycopeptidase F): N-glycan groups を除去する酵素。MS の前処理にも有効である。
広告
References
ページ分割のため番号が飛んでいますが、本文とは対応しています。
- タカラバイオ ウェスタンブロッティング実験ハンドブック. 2014a. Web pdf. Link.
- ATTO テクニカルマニュアル 化学発光 (ケミルミ) 検出のコツ. Web pdf. Link.
- Bensaccount at en.wikipedia [CC BY 3.0], from Wikimedia Commons.
- BioTechnical フォーラム, Western blotting での分子量のずれ。Link.
Yotsu-Yamashita et al. 2010a. Distribution of homologous proteins to puffer fish saxitoxin and tetrodotoxin binding protein in the plasma of puffer fish and among the tissues of Fugu pardalis examined by Western blot analysis. Toxicon 55, 1119-1124.Christofk et al. 2008a. The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumor growth. Nature 452, 230-233.Bluemlein et al. 2011a. No evidence for a shift in pyruvate kinase PKM1 to PKM2 expression during tumorigenesis. Oncotarget, 2, 393-400.- Western blot or western blot? Link.
- Bio-Rad, General protocol for western blotting. Pdf file.
- GE ヘルスケア ウエスタン・ブロッティングの原理. Link: Last access 11/9/2017.
- 実験医学 online めざせウエスタンブロッティングの達人 3. Link: Last access 11/13/2017.
Galva et al. 2012a. Soymilk: An effective and inexpensive blocking agent for immunoblotting. Anal Biochem 426, 22-23.- What is the purpose of the methanol added to the transfer buffer stage in a Western blot? Link: Last access 2019/06/14.
- Six Tips for Efficient Transfer of Your Proteins Link: Last access 2019/06/14.
- 一度exposeし終えたメンブレンのre-exposeについて Link: Last access 2019/06/20.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
