免疫染色: 原理、プロトコール、注意点など
UBC/experiments/tissue_staining/immunostaining
このページの最終更新日: 2025/11/23- 概要: 免疫染色とは
- 組織の固定
- 内在性ペルオキシダーゼ活性の除去
- ブロッキング
- 抗体処理
- 検出
広告
概要: 免疫染色とは
抗体 antibody を用いて、目的とする タンパク質 を組織内 (組織切片またはホールマウント) で染色する方法を
写真 (Public domain) は、分裂細胞の蛍光免疫染色である。青色は DNA、赤と緑で異なるタンパク質を染色している。
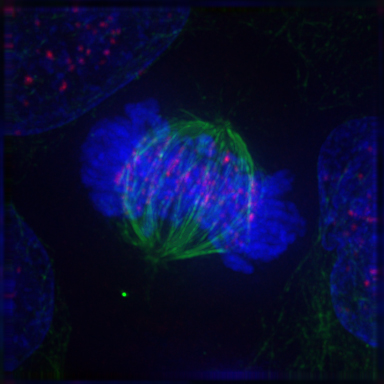
関連する実験として、同じく抗原・抗体反応を利用してタンパク質の検出・定量する Western blot がある。また、組織切片またはホールマウントで対象とする mRNA を検出するのが in situ ハイブリダイゼーション である。
免疫染色を行う場合、以下のような点を検討する必要がある。
組織の形態、固定 |
固定薬を使うかどうか、試料はホールマウントか切片か、切片なら凍結かパラフィンか。 |
抗体の選定 |
反応性、特異性。ポリクローナル抗体か、モノクローナル抗体か。 |
検出方法 |
蛍光検出か、DAB などによる染色か。 |
このページでは、上記の表のような、免疫染色の条件設定の際に考えることを中心にまとめる。具体的なプロトコールは、別に参照するページを作る予定。
組織の固定
留意すべきことは以下の 3 点である。
- 目的タンパク質の抗原性の保持 (抗体に結合できる状態が保たれているかどうか)
- 目的タンパク質の発現部位の保持 (他の場所に移動していないかどうか)
- 組織の形態の保持
固定薬を使うかどうか、試料はホールマウントか切片か、切片なら凍結かパラフィンかを決める必要がある。組織の固定法によって、以下のような違いがみられる (1)。
固定薬としては、パラホルムアルデヒド paraformaldehyde がよく使われる。
アルデヒド系試薬 |
低分子の不溶化や形態保持に優れるが、タンパク質やペプチドの抗原性保持に難点がある。ホルムアルデヒドの他、グルタルアルデヒド (図、Public domain) が使われることもある。グルタルアルデヒドは、ホルムアルデヒドよりも細胞への浸透が遅いが、固定力が強いという特徴がある。 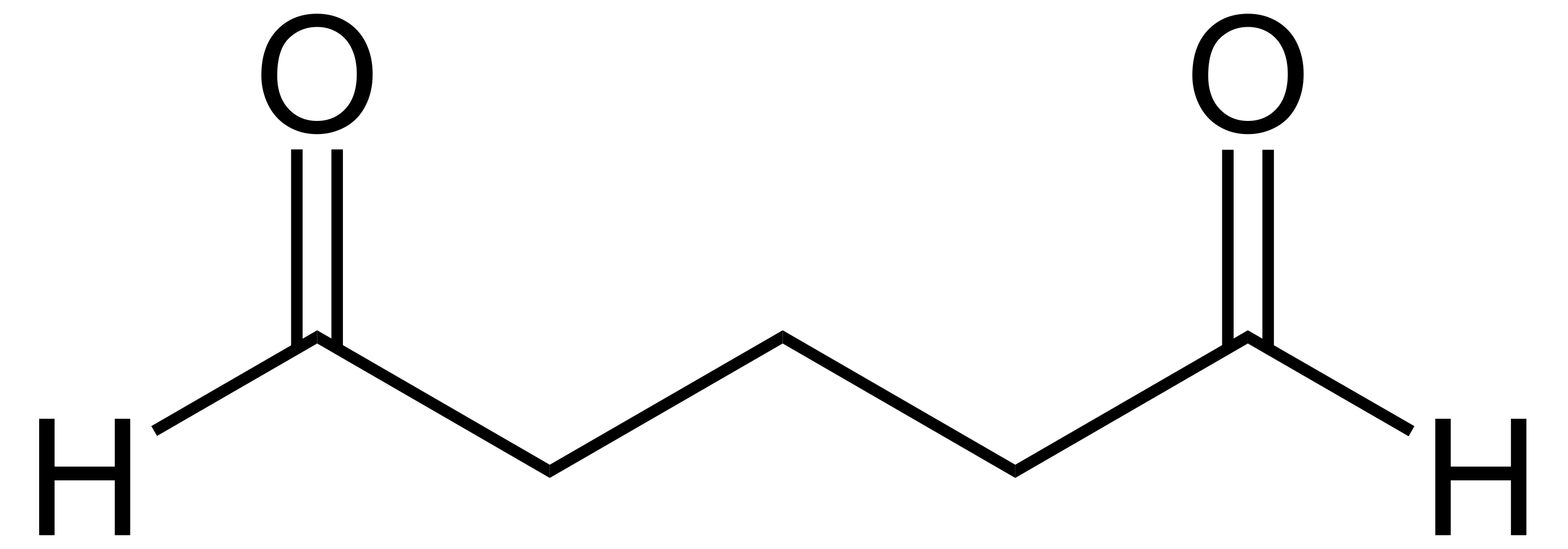
電子顕微鏡用の試料を作るときは、グルタルアルデヒド固定 + オスミウム酸固定という二重固定を行うのが一般的である。いずれ詳細を別のページにまとめる。 |
有機溶剤 |
脱水作用があり組織が収縮してしまう可能性がある。高分子の抗原保持に優れる。 |
アルコール |
|
スベルイミノ酸ジメチル |
Dimethyl suberimidate (DMS) は、タンパク質の α-アミノ基や εアミノ基と結合するな架橋剤である (参考)。架橋タンパク質の構造変化を起こしにくいため抗原の免疫活性を保持しやすく、またアルデヒド基を持たないため架橋反応後のブロック処理が不要という利点がある。 |
固定した組織は、胚や小さい生物ならば、そのまま (ホールマウント) で染色することができる。そうでない場合は、切片を作るのが一般的である。大きく分けて、凍結切片とパラフィン切片の 2 種類がある。
凍結切片 |
パラフィン切片と比べて抗原性がよく保持されるが、形態の保持が悪い。 未固定の試料をそのまま凍結する場合と、固定してから凍結する場合がある。固定凍結の場合は、形態が比較的よく保持されるようになる。 |
パラフィン切片 |
一般に形態保持に優れるが、抗原性の保持が悪い。パラフィン切片に使用可能な抗体を選んで使う。標本は常温で保存が可能である。 |
内在性ペルオキシダーゼ活性の除去
免疫染色の検出法の一つに、二次抗体にリンクしたペルオキシダーゼを使って、色素を生じる化学反応を起こす方法がある。つまり、以下の図で「酵素」がペルオキシダーゼになっているということ。
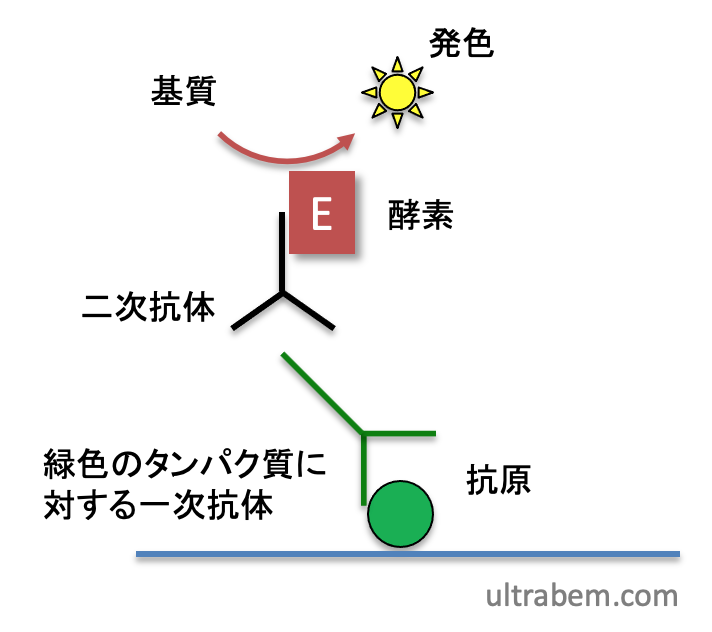
この場合、組織にペルオキシダーゼ活性が残存しているとバックグラウンドシグナルが高くなるので、これを除去する必要がある。プロトコールは、例えば以下の通り。
- 3% 過酸化水素/0.1 M リン酸緩衝液 pH 7.4 で室温 30 分
ブロッキング
抗体処理
検出
酵素抗体法による検出
蛍光二次抗体を使った検出
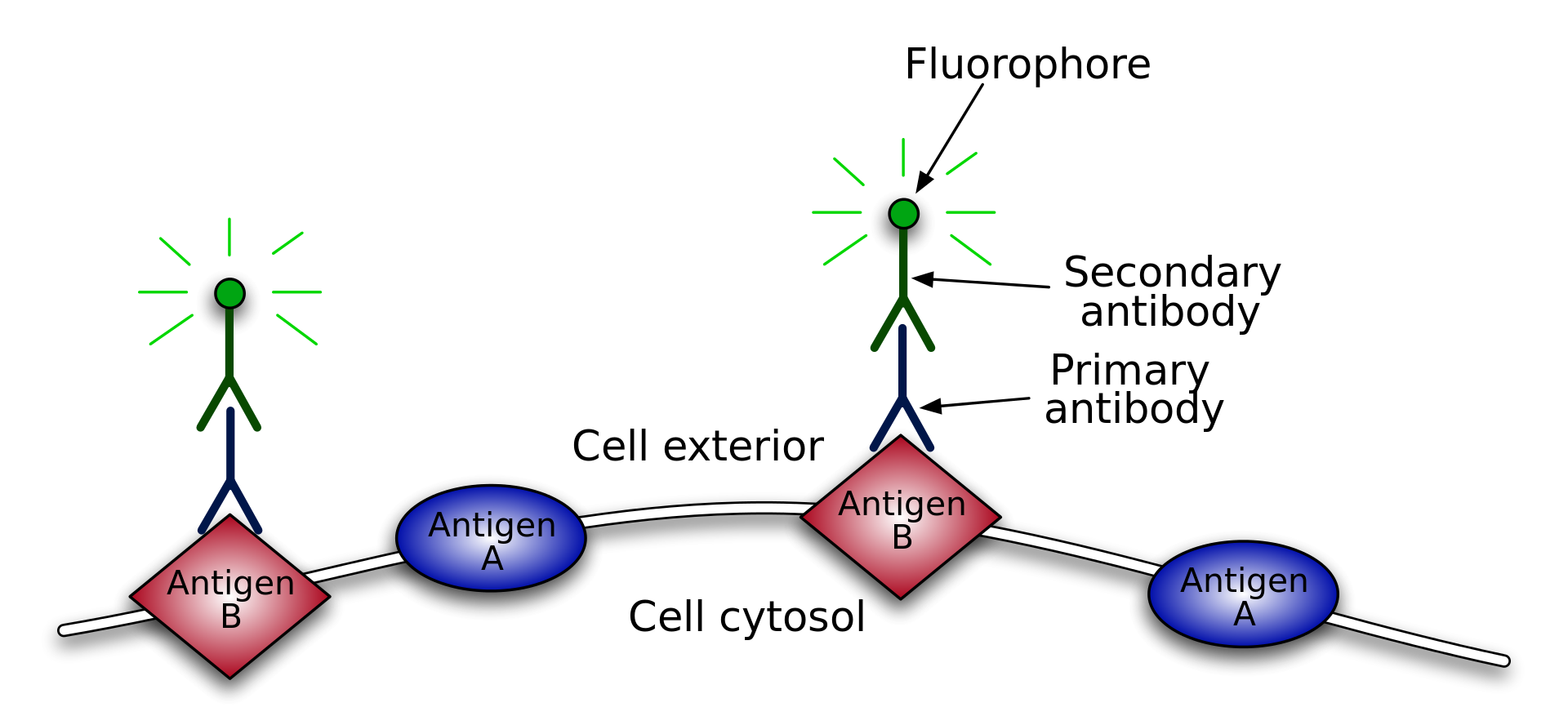
広告
References
蓮井 2012a. 免疫組織化学の基礎と応用. V. 組織・細胞の固定. 鹿児島大学レポジトリ. Link.- By David Munch, CC BY-SA 3.0, Link
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
