CBB 染色: 原理、プロトコールなど
UBC/experiments/protein/sds-page_cbb
このページの最終更新日: 2025/11/23広告
CBB 染色とは
Coomassie brilliant blue (CBB) は、SDS-PAGE 後のタンパク質染色によく使われる使われる青い色素である。これによる染色を CBB 染色という。
CBB 染色の
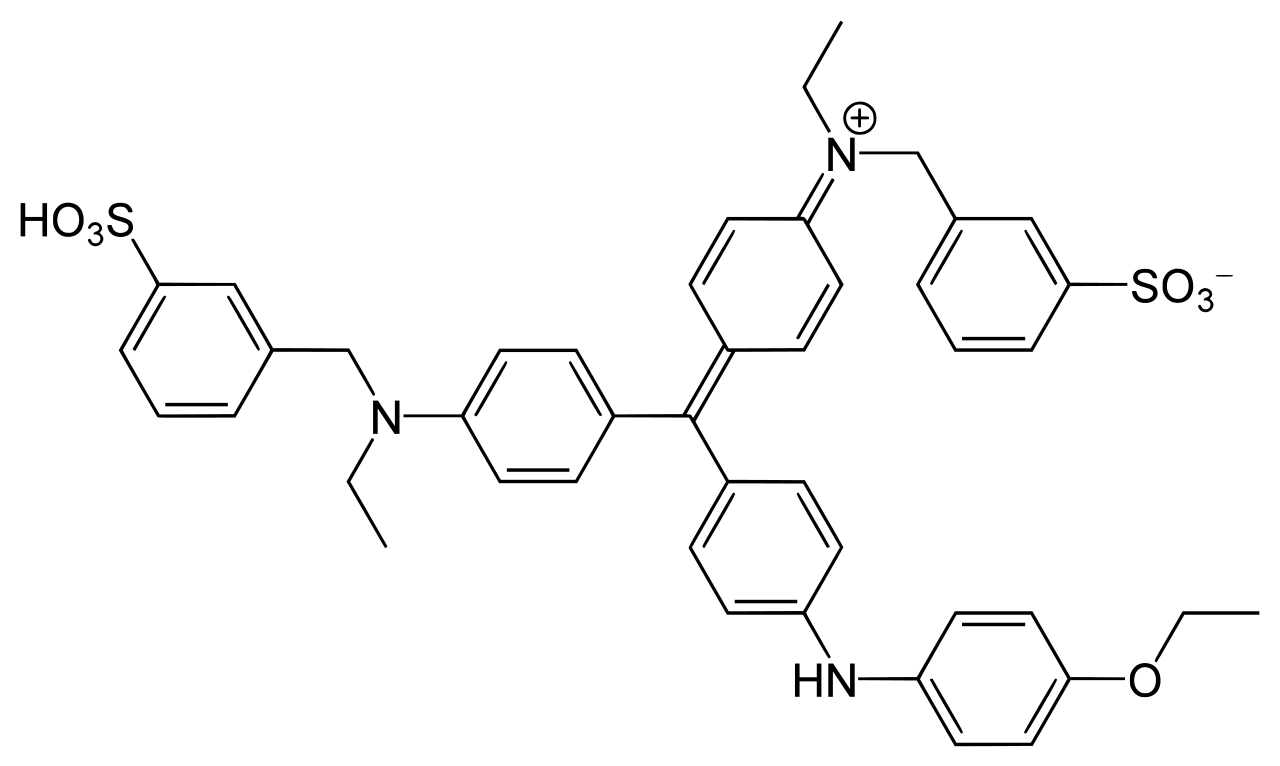
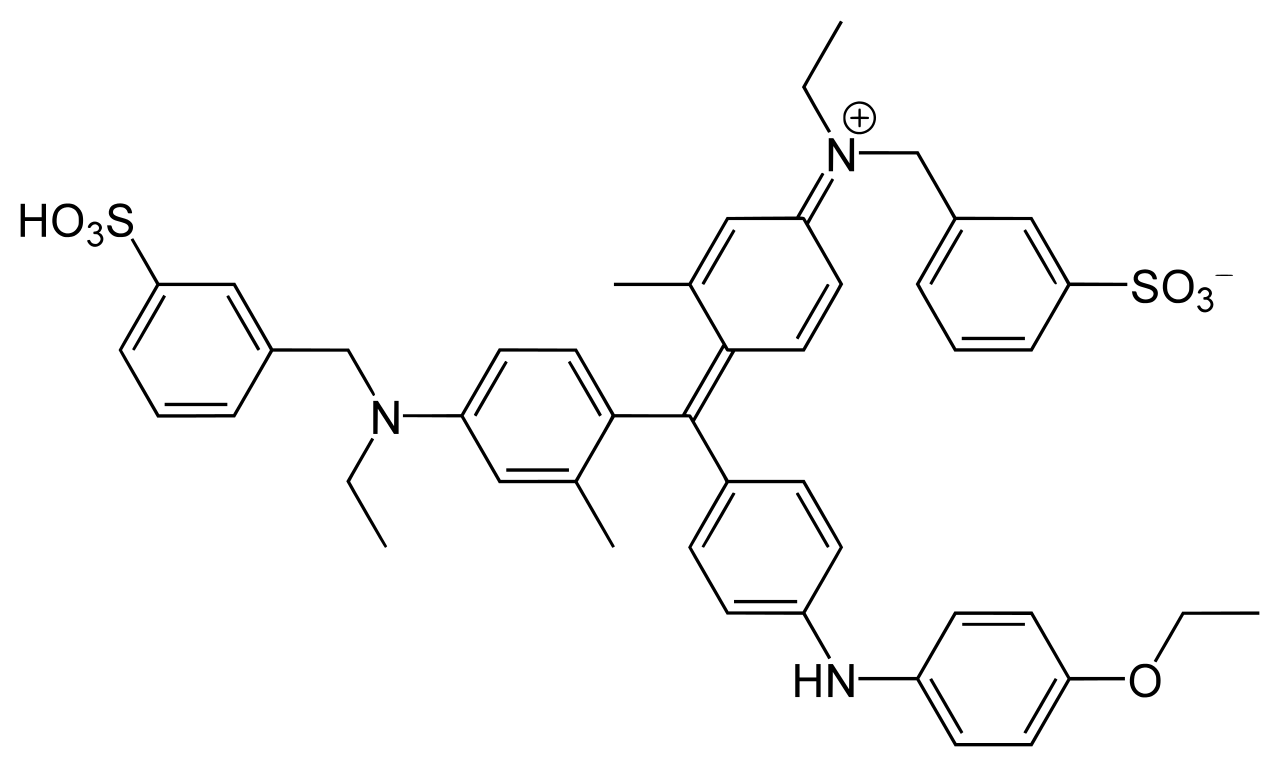
CBB には CBB G-250 と CBB R-250 の 2 種類があり、以下のように構造がわずかに異なっている (Ref 4, 5)。右上から 2 番目の炭素環にメチル基がついているのは G-250 である。CBB 染色では、プロトコールによってどちらも使われるようである。
タンパク質濃度測定法の一つ、Bradford 法 でも G-250 が使われる。
|
|
CBB R-250 |
CBB G-250 |
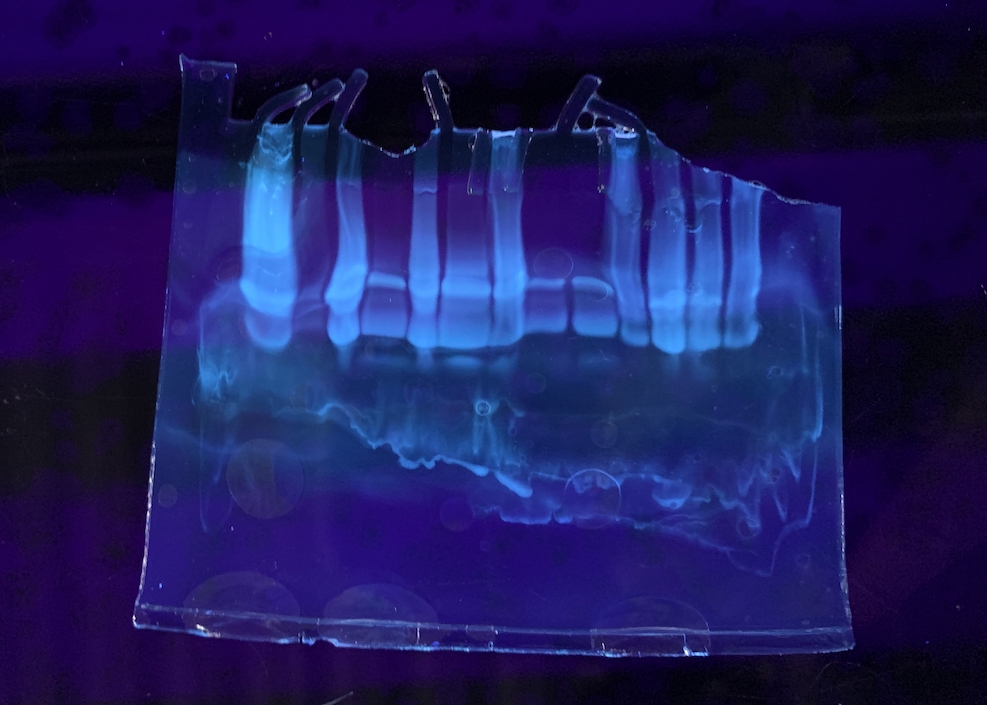
以下は SDS-PAGE 後のゲルを CBB 染色したもの。バックグラウンドが十分に脱色されていないが、このような感じに染まる。

CBB 染色の検出限界
検出限界は「1 つのバンドまたはスポットに含まれるタンパク質量」である。つまり、トータル数十 ng のタンパク質を泳動・染色しても、1 つのバンドあたりの量はずっと少ないので、はっきりした染色像は得られないだろう。
検出限界に関する資料をいくつか表にしておく。
通常の染色では、10 - 20 ng/バンド程度。エンハンサー試薬を追加することで、3 - 5 ng/バンド程度まで感度を上げられる。写真付き。 |
|
井上, 菓子野 (2009). SDS-PAGE. 低温科学 67, 359-371. |
「検出限界はタンパク質にも拠るが 8-16 ng である。ダイナミックレンジは、125 - 1000 ng である」。 |
メタノールを使用した伝統的なプロトコール
メタノールを使用した染色
伝統的なプロトコールでは、1 L の CBB 染色液の組成は以下の通りである (1)。
- CBB R-250: 2.5 g (終濃度 0.25%, w/v)
- メタノール: 500 mL (50%, v/v)
- 酢酸: 100 mL (10%, v/v)
- 蒸留水: 400 mL
メタノールを使用した脱色
脱色液の一般的な組成は、蒸留水に対してメタノール 5%、酢酸 7% である (いずれも終濃度)。
新しいプロトコール
メタノールは有害なので、これを使わない様々な組成が確立されている。
エタノールとリン酸を使う方法
例えば エタノール とリン酸を使う方法である (2)。染色液の 1 L を作るときの組成は
- CBB G-250: 0.2 g (0.02%, v/v)
- 硫化アルミニウム 14-18 水和物: 50 g (5%, w/v)
- エタノール: 100 mL (10%, v/v)
- リン酸 orthophosphoric acid (85% 溶液): 23.5 mL (2%, v/v)
脱色液の組成は以下のとおり。染色液から CBB と硫化アルミニウムを除いているだけである。
- エタノール: 100 mL (10%, v/v)
- リン酸 orthophosphoric acid (85% 溶液): 23.5 mL (2%, v/v)
この方法はメタノールフリーだが、硫化アルミニウムがややマイナーな試薬であること、エタノールはメタノールよりも高価であることなどから、以下の塩酸 HCl を使う方法の方が使いやすい。
塩酸を使う方法
文献 3 の論文。アラフォーバイオ系研究者 @osYZtdWoeHsph6C さんのツイートでこの方法を知り、文献を読んで以下にまとめた。
- Bidistilled water (2 回蒸留した蒸留水) 1 L に CBB-G 60 - 80 mg を溶かす。2 - 4 時間攪拌と書かれている。結果の比較はしていないが、CBB-R でも OK なようだ。
- 塩酸 3 mL を加える。Concentrated HCl と書いてあるが、濃度は特定されていない。この染色液は室温で数ヶ月は安定である。
- ゲルを bidistilled water に入れ、30 秒間加熱。沸騰する前に止める。3 - 5 分間振盪し、水を交換。これを計 3 回繰り返す。この目的は SDS をゲルから除くことで、
このステップが効果的な染色に重要である 。充分量の水を使い、しっかりとマニュアル通りゲルを洗浄すること。 - CBB 溶液を入れて電子レンジで 10 秒加熱してシェーカーへ。1 分後にはバンドが見え、15 - 30 分後にはシグナルが十分強くなる。
- 脱色も bidistilled water でやっている。
論文には SDS-PAGE の条件なども詳しく書かれているが、どの loading buffer でもどの SDS-PAGE gel でも OK と書いてある。感度も通常の CBB と同等。
上にも書いたが、CBB 染色前の洗浄が不十分だと感度が下がる (3)。この部分は手を抜かないこと。Residual SDS が邪魔をしているのだろうと書いてある。
キットを使う方法
いろいろなメーカーから、感度、安全性などが改良されたキットが販売されている。使ったことがあるのは、たとえば ナカライテスクの CBB Stain One。この液と水だけで染色が完了するので便利。ミニゲルのプロトコールの概要は以下。シェーカーで振とうしながら。電子レンジを使った方法もあるので、リンク先も参照のこと。
- 精製水 100 mL, 5 min の洗浄を 3 回。経験的には、前の方法と同じで、これをしっかりやらないと良く染まらない。
- CBB Stain One に 60 分。
- 精製水で数回リンス。必要に応じて、バンドがはっきり見えてくるまで精製水中で脱色。2 日以上脱色すると、バンドが多少退色することがあるらしい。
その他メモ
CBB は時間がかかるので、stain-fee のゲルというのも販売されている。DNA のアガロースゲルのように、泳動後に UV で検出できる。
広告
References
- CBB 染色液の調製, ライフサイエンスプロジェクト. Link.
Dyballa & Metzger 2009a. Fast and sensitive colloidal coomassie G-250 staining for proteins in polyacrylamide gels. J Vis Exp 30, e1431.Lawrence & Besir, 2009a. Staining of proteins in gels with Coomassie G-250 without organic solvent and acetic acid. J Vis Exp 30, e1350.- By --Phillsox - selfmade by using Chemsketch 10.0 and Inkscape, Copyrighted free use, Link
- By Yikrazuul - Own work, Public Domain, Link
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
