肥満、糖尿病に関係が深い核内受容体 PPAR:
構造、機能、リガンド、アイソフォームなど
UBC/protein_gene/p/ppar
このページの最終更新日: 2025/11/23- 概要: PPAR とは
- PPARs のリガンド
- PPARs の結合タンパク質
- PPARs の標的遺伝子
- PPARα について
- PPARα KO mouse
- PPARβ/δ について
- PPARβ/δ KO mouse
広告
概要: PPAR とは
Peroxisome proliferator-activated receptor (PPAR) は、核内受容体 の NR1C ファミリーに属する転写因子である。
レチノイド X 受容体 (RXR; retinoid X receptor) とヘテロダイマーを形成し、PPRE (PPAR-responsive regulatory element) に結合して転写調節を行う。脂質代謝、炎症反応、脂肪細胞分化などに関わる遺伝子の転写を調節する。
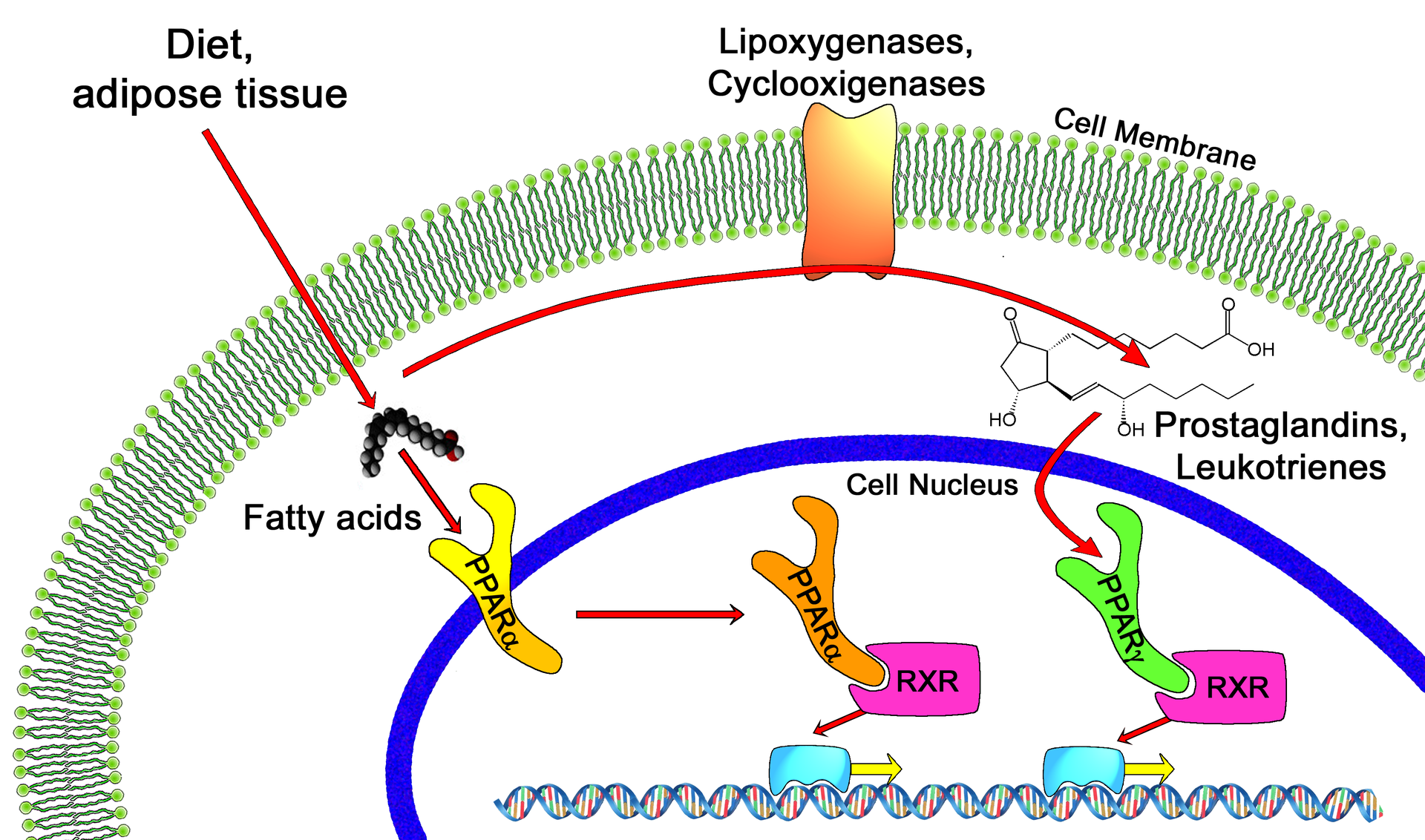
哺乳類には、PPARα, PPARβ/δ, PPARγ の 3 つのアイソフォームがある。β と δ は、別々に発見されたが同じ分子であるため、一般に β/δ のように表記される。
アイソフォームには、大まかに次のような特徴がある。
PPARα |
1990 年に最初に発見された PPAR。肝臓、腎臓、心臓、筋肉など β酸化 の盛んな組織で多く発現している。特に肝臓に多いという記述もある (4) が、ユビキタスと表現されることも多い。 多くの組織で β酸化および ケトン体 の生成を促進する。肝臓では糖新生も促進し (7)、他の組織にグルコースを供給する。 |
PPARβ/δ |
ヒトではユビキタスに発現、マウス では 胃および腸で高発現。 筋肉で β酸化および脂肪酸の取り込みを促進。脂肪細胞やマクロファージでも発現しており、NF-κB などの炎症因子の活性を抑制 (4)。 |
PPARγ |
詳細は PPARγのページ に記した。 β酸化を促進する αおよびβと異なり、脂肪細胞の分化や組織への脂肪の蓄積を促進する。脂肪組織、大腸および脾臓で高発現 (5)。マクロファージでも高発現。 γ1 と γ2 のアイソフォームがある (4)。γ2 の 3' 末端には 90 塩基の exon が一つ付加されている。 γ1 は脂肪組織を含む多くの組織で発現するが、γ2 の発現は通常は脂肪組織に限定されている (4)。過栄養、肥満などの条件下で γ2 の発現が肝臓などでみられるにようになる。 |
PPARs のリガンド
PPARs は 脂肪酸 やエイコサノイドと結合して活性化する。このほか、多くの小分子がリガンドとして作用し、高血糖などの治療に使われている。
一般に、PPARα は飽和および不飽和脂肪酸に対して同程度の親和性を示すが、β/δ および γ は PUFA に高い親和性を示す傾向がある (5)。
PPAR 全般 |
とりあえずはここに全体的な点を記載する。いずれかのアイソフォームに特異的であるという情報が入ったら、それぞれの項目に振り分ける。
|
PPARα |
|
PPARβ/δ |
|
PPARγ |
以下の 2 つは、ともにインスリン抵抗性を改善し、抗炎症作用を示すリガンドである (4)。
5-oxo-15(S)-hydroxyeicosatetraenoic acid and 5-oxo-eicosatetraenoic acid はともにアラキドン酸分解物で、γ のリガンド (9)。 |
PPARs の結合タンパク質
PPARs には、多くのタンパク質が結合する。PPARs を活性化する coactivator や、抑制する repressor などのように分類されている。
RXR |
Retinoid X receptors。 |
|
PPARγ coactivator 1α |
|
PPARs の標的遺伝子
PPARs の標的遺伝子は多岐にわたり、まだごく一部しか以下の表として整理しきれていない。
CPT1 |
Carnitine palmitoyltransferase 1 (5)。α の標的。 |
FATP1 |
Fatty acid transport protein 1 (5)。α の標的。 |
Nanog |
iPS 細胞の樹立に重要な Nanog も PPAR の制御下にあることが報告されている (6)。 |
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
PPARα について
PPARα は、肝臓、腎臓、心臓、筋肉などβ酸化の盛んな組織で多く発現している。主としてエネルギーが不足したときに活性化され、β酸化を通じて ATP の産生を促進する。
また、肝臓はエネルギー不足時に 糖新生 を行い、他の組織にグルコースを供給するという役割がある。肝臓での糖新生も PPARα に制御されている。
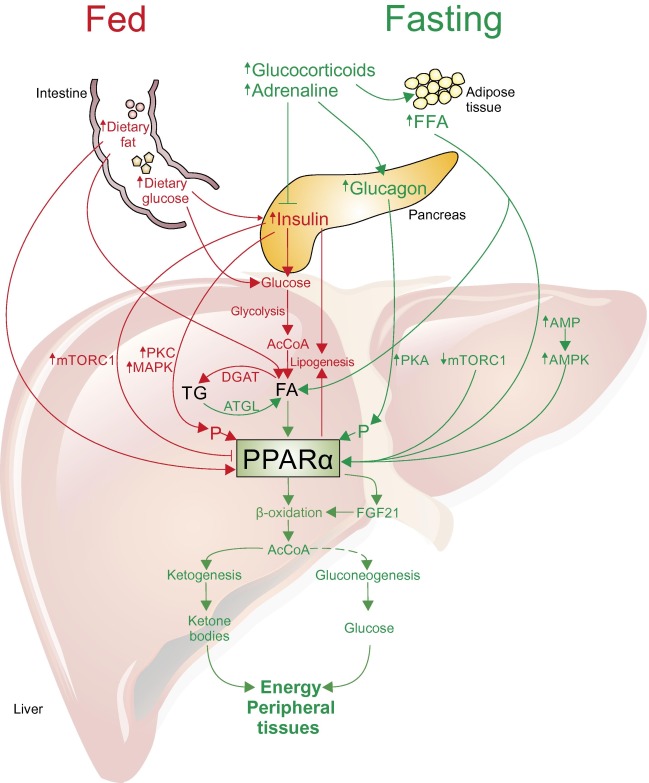
主な標的遺伝子は CPT1A, CPT2, HMGCS2 など。また PDK4 の発現を誘導し、ピルビン酸からアセチル CoA への転換を抑制する。つまりグルコースの節約である。
免疫反応も制御する。たとえば、リポポリサッカロイドによる血中 TNFα の上昇は PPARα KO で抑制され、PPARα アゴニストで促進される。
PPARα KO mouse
肝臓特異的 KO、マクロファージ特異的 KO などが作られ、解析されている。
> PPARα-null mouse の表現型などをまとめた総説 (9)。
- 肝臓でβ酸化が低下する。ミトコンドリアおよびペルオキシソームにおけるβ酸化の律速酵素、medium-chain acyl-CoA dehydrogenase および acyl-CoA oxidase 1 が PPARα の標的であることによる。
- 絶食時には脂肪細胞から肝臓に脂質が輸送されるが、PPARα-null mice は脂質を利用することができないため、脂肪肝になる。
- 肝臓特異的 KO の場合は、他の組織での β 酸化が多少の補償をするため、脂肪肝の程度はマイルドである。
KO mice は遊離脂肪酸量が高くなるが、血液中のグルコースおよびケトン体濃度が低下する。これらの結果は、KO mice で β酸化が抑制されていることを示唆する。糖新生も抑制される。
PPARβ/δ について
PPARβ/δ は、飽和および不飽和長鎖脂肪酸によって活性化される。また、prostacyclin というリガンドも知られている。
β酸化を活性化する機能がある。アゴニストで処理した L6 で、脂肪酸の取り込みと β酸化が活性化する。
運動で PPARβ/δ の発現量が上がる。ガン細胞の生存率との間にも相関がある。
広告
References
Selesniemi et al. 2011a. Prevention of maternal aging-associated oocyte aneuploidy and meiotic spindle defects in mice by dietary and genetic strategies. PNAS 108, 12319-12324.Selesniemi et al. 2011a. Maternal pregestational BMI is associated with methylation of the PPARGC1A promoter in newborns. Obesity 17, 1032-1039.Xie et al. 2015a. Placental DNA mehylation of peroxisome-proliferator-activated receptor-γ co-activator-1α promoter is associated with maternal gestational glucose level. Clin Sci 129, 385-394.Corrales et al., 2018a . PPARs and metabolic disorders associated with challenged adipose tissue plasticity. Int J Mol Sci 19, 2124.Khuchua et al. 2018a. Elucidating the beneficial role of PPAR agonists in cardiac diseases. Int J Mol Sci 19, 3464.Lee et al. 2018a. Peroxisome proliferator-activated receptor α agonist and its target Nanog cooperate to induce pluripotency. J Clin Med 7, 488.Pawlak et al. 2015a. Molecular mechanism of PPARα action and its impact on lipid metabolism, inflammation and fibrosis in non-alcoholic fatty liver disease. J Hepatol 62, 720-733.Issemann et al. 1990a. Activation of a member of the steroid hormone receptor superfamily by peroxisome proliferators. Nature 347, 645-650.Wang et al. 2020a. PPARs as metabolic regulators in the liver: Lessons from liver-specific PPAR-null mice. Int J Mol Sci 21, 2061.- By Mark Somoza - Own work, CC BY 2.5, Link
Aprile et al. 2018a. PPARgΔ5, a naturally occurring dominant-negative splice isoform, impairs PPARg function and adipocyte differentiation. Cell Rep 25, 1577-1592.
Some references are an open-access article distributed under the terms of the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited. Also see 学術雑誌の著作権に対する姿勢.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
