水のイオン積と pH: 生化学的な解説
UBC/other_topics/biochem_basic/pH
このページの最終更新日: 2025/11/23- 水の解離とイオン積
- pH とは
- pH に関する様々な話題
- 酸性溶液が生物に与える影響
- 温度が上がると pH は下がる
- ケミカルシフトは pH に影響を受ける
広告
酸・塩基についての項目は、以下の 5 つのページにまとまっている。体系的に学びたい人は、以下の順に読むことをお勧めする。
- 質量作用の法則と平衡定数
- ルシャトリエの原理
- 酸・塩基の定義
- 水のイオン積と pH (このページ)
- 解離定数
- 緩衝液 buffer について
水の解離とイオン積
水 H2O は、酸・塩基を考える際には特殊な物質である。水は
H2O ⇌ H+ + OH-
と電離するので、アレニウスの定義によると
また、水は上記の反応によって環境中の H+ 濃度を上昇させるほか、以下の反応で H+ 濃度を減少させることもできる。
H2O + H+ ⇌ H3O+
したがって、ブレンステッド・ローリー (Brønsted & Lowry) の定義においても、水は酸でも塩基でもあると言える (もっとも、ブレンステッド・ローリーの定義では、全ての酸が環境中の H+ 次第で塩基として働くが)。
このページでは、pH を理解するために、まず水の解離 dissociation について考えてみる (1)。
水の解離
水の解離の式について、平衡定数 K を考える。これは解離反応なので、K は解離定数でもある。
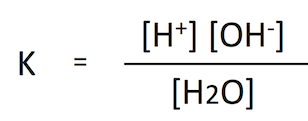
このとき、質量作用の法則と平衡定数のページにあるように、
平衡定数は、一般にギブスの自由エネルギー ΔG と次の関係になる。
ΔG = -RT ln K
これを使うと、K が 1.8 x 10-16 mol/L と一意に定まる。
イオン積
水の分子量は 18 なので、1リットルの水は 1000 ÷ 18 = 55.56 モルである。つまり、下の式において [H2O] = 55.56 である。
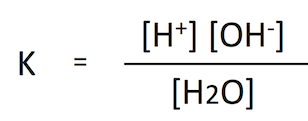
この 2 つの値から [H+] と [OH-] も算出できる。[H+][OH-] = 55.56 x 1.8 x 10-16 = 1.0 x 10-14 であり、[H+] と [OH-] の濃度は等しいので、それぞれが 1.0 x 10-7 となる。
ここで一つの仮定をおく。一般に、生化学での式変形は「法則に当てはめる → 何かを仮定して変数を減らしたりする → さらに式変形できるようになる → 意味のある形が得られるまでこれを繰りかえす」 というのが原則である。
ここで導入する仮定は、
この仮定から、
K × [H2O] = [H+] x [OH-] = 1.00 x 10-14 = 一定
である。この K × [H2O] をイオン積といい、一般に
イオン積という概念のメリットは、
- 解離定数の値と、[H+] = [OH-] = 1.0 x 10-7 から、解離している水分子の割合も導くことができる。H+ と OH- に解離している分子の割合はわずか 1.8 x 10-9 で、水はかなり安定な分子であることがわかる (1)。
pH とは
pH = -log[H+] = -(-7) = 7
となる。p は英語の power である。
イオン積の式の対数をとると、
logKW = log[H+][OH-] = log10-14
したがって、
pH + pOH = 14
という非常にシンプルな式が導けることになる。
イオン積の使い方
2.0 x 10-6 mol/L の KOH 溶液があるとする。KOH は強塩基なので、全てが K+ と OH- に解離していると仮定してよい。
- このとき、KOH 由来の OH- の濃度は 2.0 x 10-6 mol/L である。
- KOH の存在は水の解離には影響を与えないので、水由来の OH- の濃度は 1.0 x 10-7 mol/L である。
- よって、全体の OH- の濃度は 2.1 x 10-6 mol/L となる。
- pOH = -log (2.6 x 10-7) = -[log(2.6) + log(10-6)] = -(0.41-6) = 5.56
ここでイオン積が活躍する。
pH = 14 - 5.56 = 8.44
である。以上のように
ここを理解したら、次は解離定数のページで酸・塩基の重要な概念、
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
pH に関するさまざまな話題
酸性溶液が生物に与える影響
酸性溶液は有害であるが、具体的にどういうメカニズムで生体にダメージを与えるのだろうか? 重要な点の一つは、細胞外 pH を細胞内 pH を区別することである。
> 揮発性の短鎖 脂肪酸 は 細胞膜 を透過し、直接細胞内 pH を下げる (2)。
- Butyrate, propionate, acetate など。
- これらの脂肪酸は発酵 fermentation の結果生じるので、自然界に存在する acid stress である。
- 非解離状態の方が電荷が弱いので、細胞膜を通過しやすい。
- 結果として、より多くの酸が細胞に入ってしまう。上記の現象を加速させるといっても良い。
> バクテリアは、アミノ酸デカルボキシラーゼでアミノ酸と H+ を反応させる (2)。
- H+ を消費するための反応で、
低 pH に対する応答 である。 - サルモネラでは Lys + H+ でカダベリン cadaverine が作られる。
- カダベリンは、トランスポーターによって細胞外のリシンと交換される。
- 大腸菌は グルタミン酸 と H+から GABA を、アルギニン と H+ から agmatine を合成する。
pH と温度
温度は pH に影響する。
水の解離は吸熱反応であるため、温度が上がると解離が進み、H+ の濃度が上がる。すなわち pH は下がる。HEPES の場合も、温度が上がるほど pH は低下する (2)。
pH とケミカルシフト
ケミカルシフト (または化学シフト) とは、NMR において官能基の特徴を表す値の一つである。pH の影響に関する詳細は ケミカルシフトのページ に記載している。
pH の変化は NMR で検出する magnetic property を変化させるため、ケミカルシフトにも影響する。ただし、その影響はもちろん分子や官能基によって異なる。例えば citric acid のダブレットは pH に影響を受けやすい。
広告
References
- Amazon link: 平尾, 加藤 1988. 化学の基礎 分子論的アプローチ (KS化学専門書)
.
Bearson et al. 1997a (Review). Acid stress responses in enterobacteria. FEMS Microbiol Lett 147, 173-180.- 同仁堂ウェブサイト. Link.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
