PCR: 目次、原理およびトラブルシューティング
UBC/experiments/dna/pcr
このページの最終更新日: 2025/11/23- 概要: PCR とは
- PCR 反応液の組成
- さまざまな PCR
- トラブルシューティング
- PCR が増えない
- 非特異的産物が多い
PCR 関連ページへの目次
- PCR プライマー: 設計方法、汎用プライマーの配列など
- PCR 阻害物質
- リアルタイム PCR
- DNA 抽出、DNA の濃度および純度測定、アガロースゲル電気泳動
広告
概要: PCR とは
PCR(polymerase chain reaction, ポリメラーゼ連鎖反応)は、特定の DNA 断片を増幅する技術である。現代の分子生物学の基盤になっているとともに、遺伝子診断、病原体検出、環境アセスメントなど多くの分野で使用されている。
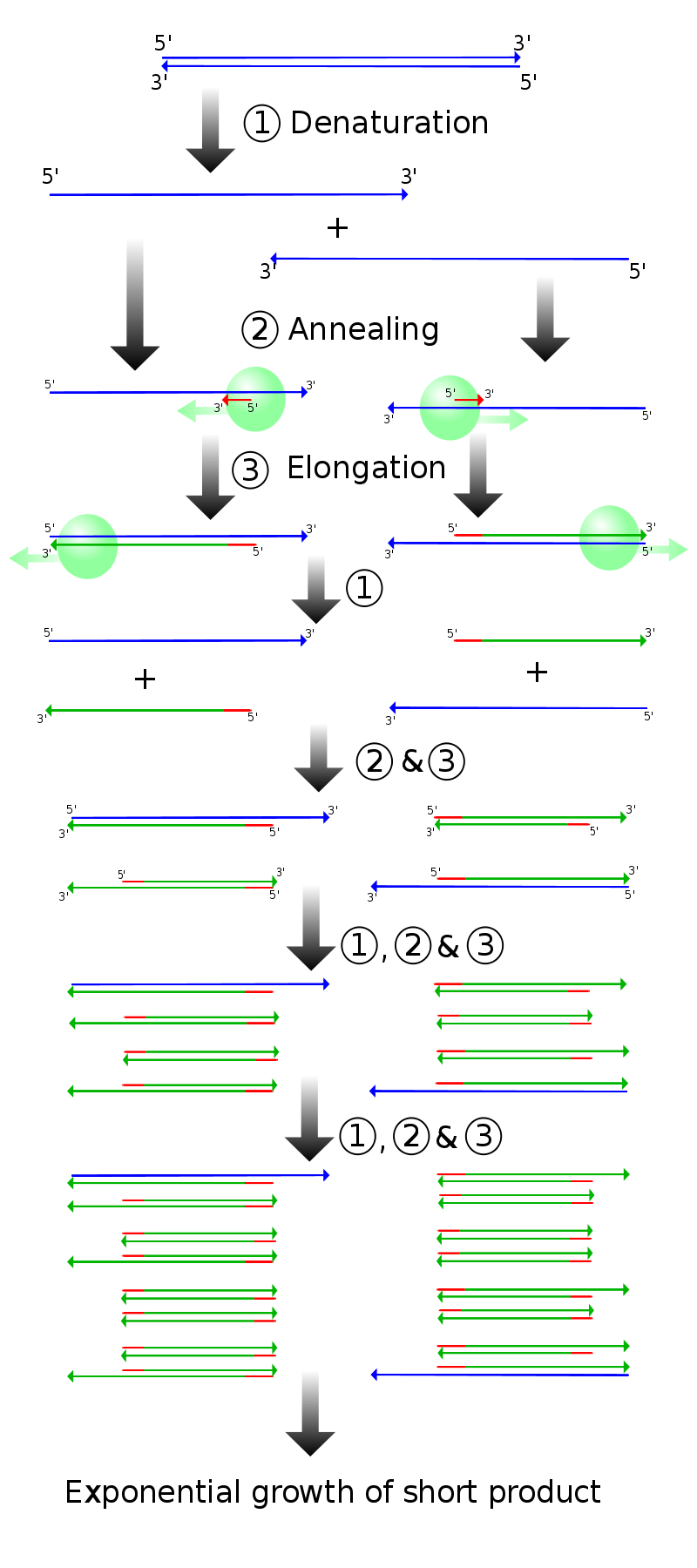
一般に、PCR では DNA のターゲット領域を特異的に認識するプライマーを用いて、DNA ポリメラーゼ酵素の働きにより DNA を複製する。プライマー、酵素などを小さいチューブに入れ、変性、アニーリング、伸長という 3 段階の温度処理を実行するサーマルサイクラーにセットする。図は ref. 4 より。
PCR 反応液の組成
この項目では、PCR 反応液に入れるべき試薬について説明する。
テンプレート DNA
DNA ポリメラーゼ
PCR に使われているのは、耐熱性の DNA ポリメラーゼ である。PCR に使う DNA ポリメラーゼを決定する際に重要なパラメーターは、
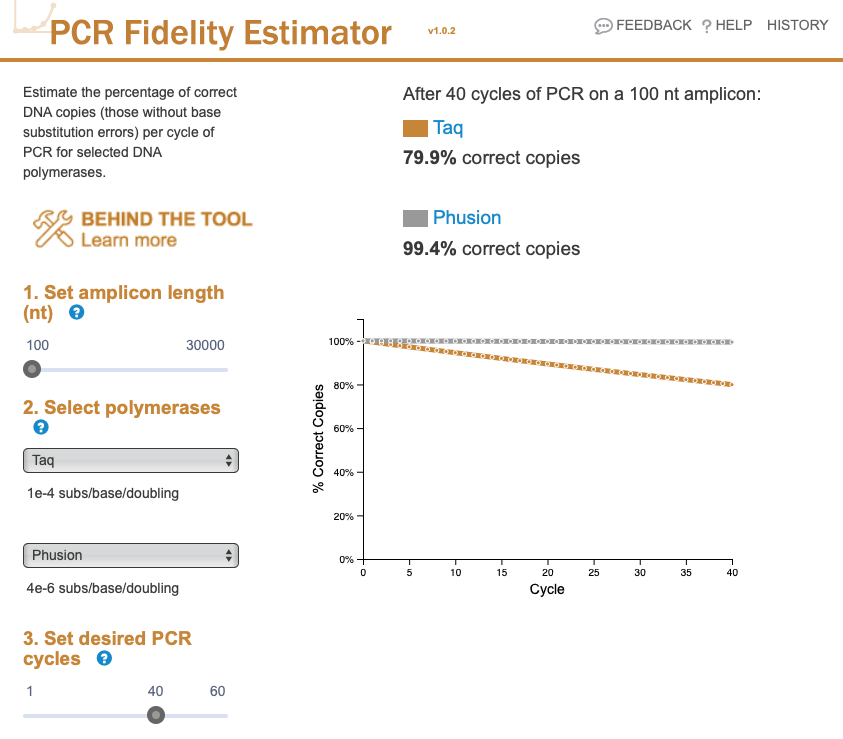
正確性は、とくに増幅産物のサイズが大きいときに問題になる。NEB が、これをうまく可視化できるページを作っているので使ってみたい。PCR Fedelity Estimator という。このページでは、以下のパラメーターを設定し、最終的に得られる PCR 産物の何%が、テンプレートと同一の配列をもつかが計算される。
- 増幅産物のサイズ。長いほどエラーの入る確率が高くなる。ロング PCR では、正確性の高い酵素を使わないとダメ。
- 2 つの酵素を比較する。例として、正確性の低い Taq と、正確性の高い Phusion を比較してみる。このページでは、Q5 という酵素が最も正確性が高いようだ。
- PCR のサイクルも設定できる。今回は 40 で。
増幅産物が短い (100 bp) の場合、Taq と Phusion の違いは小さい。それでも、Taq で 40 サイクルの PCR を行うと、増幅産物の 80% ほどしか、本来の配列をもっていないことになる。
PCR では、変異をもった DNA が作られるのは避けられない。最初の方のサイクルで作られた変異 DNA は、その後の全てのサイクルで鋳型となり、指数関数的にその量が増える。そのため、正確性の差はサイクル数が多いほど大きくなるわけである。
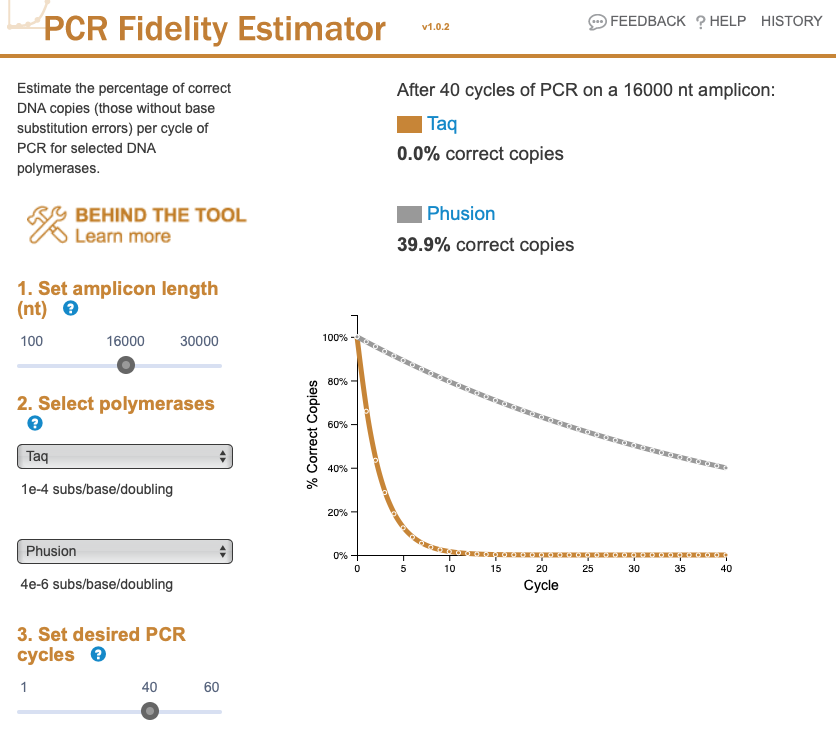
増幅産物のサイズを、脊椎動物の ミトコンドリア DNA のサイズに近い 16,000 nt にセットしてみる。Taq では、正しい配列をもった DNA は 0。実際、Taq でこのサイズの DNA を増やすのは現実的に無理だろう。
Phusion でもわずか 40% である。シークエンスを決める場合などには、このことも考慮して実験系を組む必要がある。
dNTP
PCR 用の dNTP は、たとえば 10 mM (つまり 2.5 mM each) などの濃度で提供される。濃度は製品によって異なっているので、注意深くチェックすること。
dNTP の量
一般に、PCR 反応液中の dNTP 量は
dNTP の終濃度
終濃度は
いくつかの酵素について、マニュアルで推奨されている dNTP 量および終濃度をメモしておく。
- KAPA HiFi PCR Kit では、25 µL の反応系に 7.5 nmol。終濃度は 0.3 mM each になる。
- ThermoFisher の解説ページ (5) では、一般的な PCR での dNTP 終濃度は 0.2 mM each としている。
- Takara Clontech Advantage-HF 2 PCR Kit では 10x HF dNTP mix がキットに含まれており、濃度は記載されていないようである。"carefully balanced mixture of the four dNTPs" と書かれているので、もしかすると濃度が均等ではないのかもしれない。
マグネシウムイオン Mg2+
マグネシウムイオン Mg2+ は、DNA ポリメラーゼの cofactor として必要であるため、PCR 反応液には必ず含まれていなければならない成分である。
Mg2+ は、DNA ポリメラーゼへの dNTP の取り込みを可能にする作用があるとともに、酵素の活性部位 active site に位置しており、プライマーの 3' 末端と dNTP ののリン酸基の間でのホスホジエステル結合形成を触媒する (5)。
Mg2+ は緩衝液に含まれていたりするので、意識しないこともあるかもしれない。試薬によっては、MgCl2 または MgSO4 溶液を別途加える必要がある。MgCl2 として提供されるのが普通だが、Pfu DNA ポリメラーゼはイオウによって PCR のパフォーマンスが安定するので、MgSO4 が使われる (5)。
一般に、MgSO4 の PCR 反応液中における終濃度は
Mg2+ 濃度が高くなると、一般に DNA polymerase の活性が上がるが、同時にプライマーとテンプレート DNA の結合も強まるので、非特異的産物が増えやすくなると書かれている (5)。
エタノール沈殿 では、塩を入れることで DNA と水分子の水素結合が阻害されて DNA が沈殿するので、Mg2+ の添加はテンプレートとプライマーの結合を阻害しそうなイメージがある。ここは疑問だったのだが、このページ の議論に次のようなコメントがある。
|
Essentially, Mg++ increases the Tm of two interacting DNA strands by shielding the negatively charged phosphodiester backbone and decreasing the electrostatic repulsion between DNA strands, i.e. it stabilizes base pairing. This way, primers that might not bind stably to a certain sequence under "normal" conditions -due to mispaired bases- may do so in the presence of higher Mg++ concentrations. |
つまり、DNA が二本鎖を形成するとき、塩基は電気的に結合しているが、DNA の鎖にあるリン酸基にある負電荷は互いに反発している。Mg2+ の正電荷はこれを中和するように働き、結果として DNA 鎖同士の結合を強めるということのようだ。ATP の 3 つの正電荷が、細胞内では Mg2+ と結合しているのと似たような理屈である。
プライマー
PCR プライマー のページへ。
さまざまな PCR
PCR の応用範囲は非常に広いため、「なんとか PCR」という用語はたくさんある。表にまとめておく。
Nested PCR |
特定のプライマー対で PCR したあと、その産物をテンプレートとして、内側に位置するプライマーでもう一度 PCR する。プライマーによる選択を 2 回かけられることになり、特異性が上がる。 |
Overhang PCR |
プライマーの一部のみがテンプレートとアニーリングする。PCR 産物に特定の配列を付加することができる。制限酵素サイトつきプライマー を用いる PCR が典型例である。 |
プライマーを設計する既知配列の隣にある領域を増幅する PCR。典型的には、外向きに設計したプライマーを使って発現ベクター全体を増幅しつつ、変異を導入したり配列の一部を除いたりするのに用いる。 |
トラブルシューティング
PCR が増えない
電気泳動 して期待通りに増幅産物が得られなかった場合、positive control を真面目に作っていれば、かなりの程度で問題点を特定できる。まず、問題点が試料の PCR であることを以下のようにして特定する。
- 電気泳動のマーカーは見えるか? 見えるなら電気泳動自体は OK。
- ポジティブコントロールは増えているか? 増えているなら酵素や PCR の機械は OK。試薬の入れ忘れもこれでチェックできる。
- まれに PCR の特定の穴が正確な温度変化をしない場合がある。どの位置のサンプルが増えないかも記録しておこう。
- 1 と 2 が OK な場合、試料の PCR に問題があることになる。以下の表を参考に対処を考える。
プライマーダイマーが多量にある場合 |
Primer dimer は、最初の熱変性ステップが始まる前にプライマー同士がアニールし伸長することで生じる (1)。したがって、primer dimer が見える場合には primer とテンプレートの結合が十分でない可能性がある。以下のような対処法がある。
|
Nested PCR を行う |
その遺伝子の cDNA 量または DNA 量が十分でない場合、nested PCR をすることで初めてちゃんとしたバンドが見えることがある。 PCR 産物を 100 倍程度に希釈し、それを鋳型として再度 PCR をする。同じプライマー対を使うよりも、それらの内側で設計された |
AT-rich な配列 |
イントロン、ミトコンドリア DNA の control region など、遺伝子を含まない部分の配列は一般に AT 含量が高く、増幅しにくい。A と T の連続配列が近接していると、局所的に DNA がステム構造を取ってしまうことが理由の一つらしい。 Takara は PrimeSTAR GXL など特殊な酵素を使う PCR を推奨している (2)。 クラシックな方法だが、高次構造形成を防ぐためにスペルミジン (3) やベタインなどを PCR 溶液に加えるというオプションもあるようだ。 このサイト には「PCR を低温でやるとよいことがある」と書いてあり、BigDye の反応系、つまりアニーリング 50°C、伸長 60°C という条件を魚類 mtDNA control region の増幅で推奨している。 |
広告
References
- Roche マニュアル. PCR の一般的なガイドライン. Pdf file.
- 快適なPCRのために. Link: Last access 2018/09/16.
Wan and Wilkins, 1993a. Spermidine facilitates PCR amplification of target DNA. PCR Methods Appl, 3, 208-210.- By Madprime - Own work, CC BY-SA 3.0, Link
- PCR Setup—Six Critical Components to Consider. Link: Last access 2020/04/11.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
