最も研究されているストレス応答タンパク質 HSP70: 機能、分子量など
UBC/protein_gene/h/hsp70
このページの最終更新日: 2025/11/23- 概要: HSP70 とは
- HSP70 の機能
- ATPase としての HSP70
- HSP70 の構造
- HSP70 のドメイン構造
- HSP70 のモチーフ
- HSP70 family
- HSP70 の発現制御
- 老化・寿命との関係
- その他未整理
広告
概要: HSP70 とは
HSP70 およびその他のストレスタンパク質には、一般に以下のような機能がある。
- 他のタンパク質をストレスによる変性から守る。
- 新しく合成されるタンパク質の折りたたみを助ける。
この機能から、ストレスタンパク質はしばしば
HSP70 は、熱ストレスによる誘導が最初に報告されたためにこの名前がついているが、のちに様々なストレスで誘導されることが明らかになっている。
HSP70 には、ミトコンドリア型、小胞体型、細胞質型など細胞内局在が異なるアイソフォームがある。また、ストレス誘導型の HSP70 と、恒常的に発現する HSC70 が知られている。これらについては、HSP70 のアイソフォーム のページにまとめた。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
HSP70 の機能
標的の最終的な構造に関する情報は持っておらず、非生産的な相互作用を軽減する (2)。
> HSP70 は標的の
- 一般に疎水性アミノ酸はタンパク質の内部に存在するが、タンパク質が変性するとフォールディングがほどけて分子表面に出てくる。
- HSP60 は molten globule 構造を認識し、HSP70 とは結合様式が異なる。
> HSP70 には、変性したタンパク質を細胞から除去する機能もある (9)。
- タンパク質分解系への輸送。
ATPase としての HSP70
HSP70 は、ATP を加水分解することでシャペロン機能を発揮する。つまり、ATP 分解酵素 (ATPase) としての機能も持っていると言える。HSP70 の in vivo での ATPase 活性は低い。つまり、細胞内では HSP70 の多くが ATP と結合した状態にある (1)。
その他、HSP70 の酵素活性に関する雑多なメモ。
- HSC70 の ATPase 活性は、in vitro で cations に影響される (2)。
- Mg2+ は HSC70 に結合し、他のカチオンと一緒に ATPase 活性を低下させる (2)。
- 大豆の HSC70 は、free nucleotide を基質として利用する (2)。
- Basal ATPase 活性は、K イオンで 10 倍程度に増大する (2)。
- In vitro では、5-12 残基のペプチドが活性を増大させる。基質で活性化されるのは珍しい (2)。
- 大腸菌 DnaJ は、DnaK (HSP70), GrpE, target と4量体を作り、ATP 加水分解を促進する (2)。
- ATP-bound state では基質との結合、解離が早く、ADP-bound state では遅い (2)。
- DnaK (HSP40 )は、HSP70 の ATPase を活性化する機能をもつ (2)。
HSP70 の構造
HSP70 は、もっとも配列の保存性が高く、原核生物 から高等生物まで普遍的に存在するストレスタンパク質である。なぜか細胞骨格タンパク質であるアクチン actin と 3 次構造が類似しており、共通の祖先をもつ paralog である可能性が考えられている (7)。
HSP70 のドメイン構造
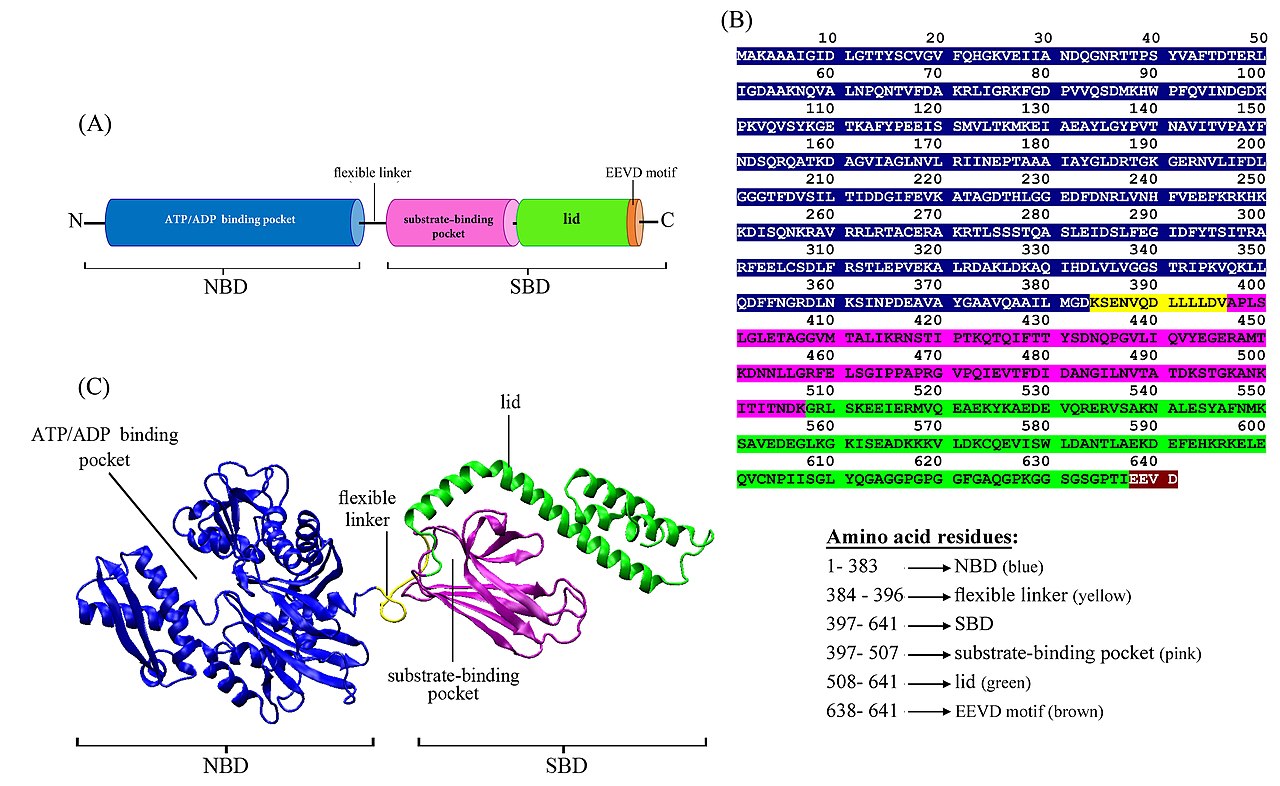
HSP70 は、以下の 3 つのドメインに分けられる (図, ref. 12)。
N-terminal nucleotide-binding domain |
ATP に結合するドメイン。HSP70 は ATP を加水分解し、そのエネルギーを利用して変性タンパク質を修復する。 |
Substrate-binding domain |
基質である変性タンパク質に結合するドメイン。 |
C-terminal domain |
Co-chaperones との結合に関わるドメイン。HSP70 の構造を制御する (7)。 |
HSP70 のモチーフ
HSP70 には、以下のような特徴的な配列 (モチーフ配列) があることが知られている。
RARFEEL |
Non-organellar consensus motif とされている (11)。 |
EEVD |
C 末端の 4 残基が、細胞内局在を反映する。EEVD は細胞質型。 |
KDEL |
小胞体型の HSP70 では、C 末端に EEVD でなく KDEL モチーフがみられる。これは ER retension signal と呼ばれる。KDEL は、HDEL (S. cerevisiae) や DDEL (K. lactis) などである場合もある。 |
HSP70 family
HSP70 に類似した構造をもつ分子は、HSP70 ファミリーと呼ばれる。分類は時代に応じて変わってきている。
> 小胞体型の BiP, HSP110, DnaK の 3 つのサブファミリーに分けた総説 (10)。
- 小胞体型の HSP70 を発見したグループの論文なので、BiP に重きがおかれている。現在では ミトコンドリア 型などもあり、この分類はアップデートされている。
HSP70 の発現制御
mRNAレベルの発現制御
- 鳥類の精子形成過程で、熱ストレスがポリAを長くすることが知られている (4)。
- HSF と結合している。熱ストレスによって HSP70 が使われると HSF がフリーになり、3 量体を形成して核移行し、HSE をもつ遺伝子の転写を促進する (8)。
老化・寿命との関係
HSP70 の過剰発現が寿命を長くするという報告が多いようである。
> ショウジョウバエで、HSP70 過剰発現による寿命延長が報告されている (5R)。
- HSP70 を含むゲノム領域が重複した系統を使用。
- 熱ストレスによって発現量を増やしている。
- HSP70 量は 10-12% 増加している。産仔数は変化しない。
> C. elegans で、ミトコンドリア型 HSP70 の過剰発現が寿命を延ばす (7R)。
- この HSP70 は、真核生物よりも大腸菌の DnaK に相同性が高い。Mortalin とも呼ばれる。
- マウスには mot-1, mot-2 が存在。ヒトでは1種類で、マウス mot-2 に相同性が高い。
- C. elegans では、加齢によって発現量は変化しないが、dauer と daf-2 変異体で発現量が高い (6R)。
その他未整理
シグナル伝達との関わり
- 通常の分子シャペロンとしての機能の他に、多くのシグナル伝達系と関連して働いている (3)。
- PKCと結合し、リン酸化による制御を受けている。
- CaN, CaM (カルモジュリン )系とも関連する。
- カルシウムイオン依存的な自己リン酸化も知られているが、リン酸化との詳細な関係は不明。
翻訳後修飾
- リン酸化、ADP-ribosylation, N-methylationなどの翻訳後修飾を受ける (2)。
- vivoでは、autophosphorylationもしくはキナーゼによるリン酸化を受ける。これは核酸結合を阻害し、活性が低下 (2)。
Hip/Hopとの関連
- Hip はHSC70とADPの解離を阻害し、シャペロン活性を増大させる (2)。
- Hop はADPリリースを促進する (2)。
広告
References
Angelidis 1999a. Eur J Biochem, 259, 505-512.Frydman 1997a (Review). Trends Biochem Sci, 22, 87-92.Lakshmikuttyamma 2004a. Molecular cloning of bovine cardiac muscle heat-shock protein 70 kDa and its phosphorylation by cAMP-dependent protein kinase in vitro. Biochemistry, 43; 13340-13347.Mezquita 2001a. J Cell Biochem, 82, 480-490.Tatar et al. 1997a. Chaperoning extended life. Nature 390, 30.Cherkasova et al. 2000a. Diverse Caenorhabditis elegans genes that are upregulated in dauer larvae also show elevated transcript levels in long-lived, aged, or starved adults. J Mol Biol 300, 433-448.Mashaghi et al. 2016a. Alternative modes of client binding enable functional plasticity of Hsp70. Nature 539, 448-451.Prahlad amd Morimoto 2009a (Review). Integrating the stress response: lessons for neurodegenerative diseases from C. elegans. Trends Cell Biol 19, 52-61.Luders et al. 2000a (Review). The ubiquitin-related BAG-1 provides a link between the molecular chaperones Hsc70/Hsp70 and the proteasome. J Biol Chem 275, 4613-4617.Rachel et al. 1997a (Review). A novel subfamily of Hsp70s in the endoplasmic reticulum. Trends Cell Biol 7, 277-282.Cottin et al. 2008a. Thermal biology of the deep-sea vent annelid Paralvinella grasslei: in vivo studies. J Exp Biol 211, 2196-2204.- By Wikibiocell - Own work, CC BY-SA 4.0, https://commons.wikimedia.org/w/index.php?curid=97106838
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
