HSP70 のアイソフォームと分子進化
UBC/protein_gene/h/hsp70_isoform
このページの最終更新日: 2025/11/23広告
概要: オルガネラ特異的な HSP70
HSP70 は一般に細胞質 cytosol および核 nucleus に局在するが、ミトコンドリア や小胞体に局在するアイソフォームもある。一般に、オルガネラ局在シグナルのために分子量が 70 Kda よりもやや大きい。発見された経緯から、別の名前で呼ばれていることもある。
細胞質・核型
通常、このタイプが「普通の」HSP70 として認識されている。C 末端の 4 残基が
小胞体型
小胞体 endoplasmic reticulum に局在するアイソフォームには、glucose-regulated protein 78 (GRP78) という名前がつけられている。この分子は HSP70-5, immunoglobulin binding protein (BiP) とも呼ばれる。
小胞体型の HSP70 は、C 末端側に
ミトコンドリア型
HSP70 にはミトコンドリアに局在するアイソフォームがあり、これは mitochondrial HSP70, mHSP70, モータリン mortalin などと呼ばれる。以下のような特徴をもつ。
- N 末端側にミトコンドリア移行のためのシグナル配列をもつ。
> Chinese hamster ovary (CHO) cell の mHSP70 に関する論文 (1R)。
- 原核生物 prokaryote の HSP70 に配列が似ている。
- In vitro mitochondria 移行実験というのが面白い。精製したミトコンドリアと混ぜると cleave される。
- さらにトリプシンで分解されなくなる。ミトコンドリアの中に入ったために酵素がアクセスできない。
- 細胞質 HSP70 と cross-react しない特異性の高い抗体を作り、免疫染色で局在を調べている。
- ミトコンドリアに主に局在するが、10-20% は細胞膜などに局在。Immunogold labeling.
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
誘導型 HSP70 と恒常発現型 HSC70
一般に、ストレスなどで発現量が増大するものを HSP70、恒常的に発現しているものを heat shock cognate (HSC70) と呼ぶ。ただし、これらの区別は分子進化を反映したものではなく、熱誘導性は convergent evolution によるものと考えられている (2, 11)。分子系統に基づいた新しい名前も提唱されている (11, 図もこの論文から)。
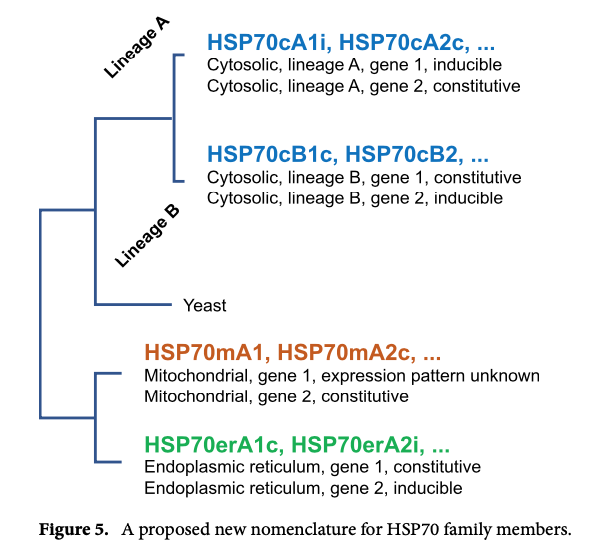
HSC70 のノックアウト マウス は nonviable であると書かれている (3)。ただし、その部分では personal communication が引用されている。
ヒト HSP70 のアイソフォーム
ヒトゲノムからは 17 の HSP70 様遺伝子と、30 の偽遺伝子が報告されている (8)。
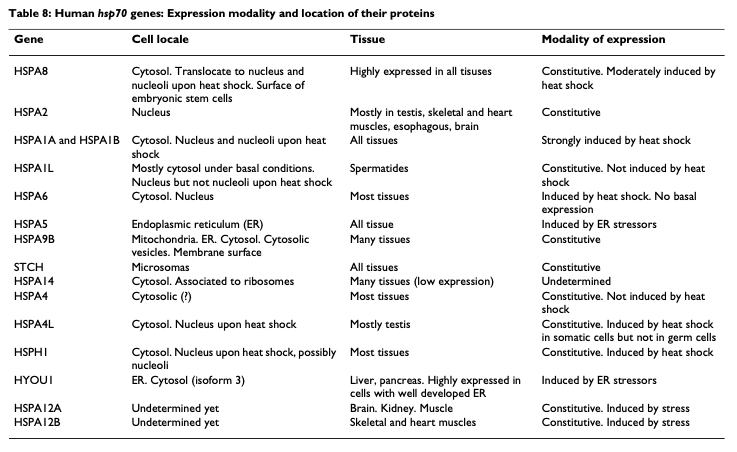
> HSP70 のアイソフォーム比較を中心とした総説 (9)。2007 で情報は古い。
- ヒトには少なくとも 8 個の HSP70 があり,シャペロン以外の役割もありそう。相同遺伝子のKO miceは異なる表現型。
- HSP70は,多細胞動物が単系統であることを示したり,動物界と菌界の関係を示したりするのに使われた。
- 酵母は8個のHSP70ホモログをもつ。うち2つはER, mitochondria局在型。
- ヒトHSP70-1a, 1bはわずか2残基しか違わない。
- タンパク質変性を伴わないストレスに対しても有効。リソソーム膜を安定化させる役割ももつため。
- HSP70-6はストレス誘導性が高い。7は転写されるが,フレームシフトのため機能しない。
- mRNAもHSP70の標的になる。3’ UTRに結合して,co-chaperonとともに安定化するらしい。
- 腫瘍でも発現している。原則として,分裂up,分化downの機能。
広告
References
Angelidis 1999a. Eur J Biochem, 259, 505-512.Krenek et al. 2013a. Convergent evolution of heat-inducibility during subfunctionalization of the Hsp70 gene family. BMC Evol Biol 13, 49.Florin 2004a. Nuclear translocation of papillomavirus minor capsid protein L2 requires Hsc70. J Virol 78, 5546-5553.Mezquita 2001a. J Cell Biochem, 82, 480-490.Tatar et al. 1997a. Chaperoning extended life. Nature 390, 30.Cherkasova et al. 2000a. Diverse Caenorhabditis elegans genes that are upregulated in dauer larvae also show elevated transcript levels in long-lived, aged, or starved adults. J Mol Biol 300, 433-448.Singh et al. 1997a. Cloning and some novel characteristics of mitochondrial Hsp70 from Chinise hamster cells. Exp Cell Res 234, 205-216.Brocchieri et al. 2008a. hsp70 genes in the human genome: Conservation and differentiation patterns predict a wide array of overlapping and specialized functions. BMC Evol Biol 8, 19.Daugaard et al., 2007a (Review). The heat shock protein 70 family: highly homologous proteins with overlapping and distinct functions. FEBS Lett 581, 3702-3710.He et al., 2008a. Cloning and characterization of a heat shock protein 70 gene, MsHSP70-1, in Medicago sativa. Acta Biochim Biophys Sin 2008, 209-216.Yu et al., 2021a. The complex evolution of the metazoan HSP70 gene family. Sci Rep 11, 17794.
Figures are cited from open-access articles distributed under the terms of the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited. Also see 学術雑誌の著作権に対する姿勢.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
