ゲル濾過クロマトグラフィー:
原理、プロトコール、トラブルシューティング
UBC/experiments/chromatography/gel_filtration
このページの最終更新日: 2025/11/23- 概要: ゲル濾過クロマトグラフィーとは
- 担体の選択
- ゲル濾過クロマトグラフィーの実際
- タンパク質 - タンパク質相互作用の証明
- タンパク質 - DNA 相互作用の証明
広告
概要: ゲル濾過とは
ゲル濾過 gel filtration は、カラムに多孔性ゲルを充填し、
図は、ゲル濾過クロマトグラフィーの原理を示したものである (5)。大きい分子が素通りし、小さい分子が担体と相互作用しながらゆっくりとカラムを通る様子が描かれている。図では小さい分子に塩 salt が例として使われているが、もちろん何の分子でも構わない。
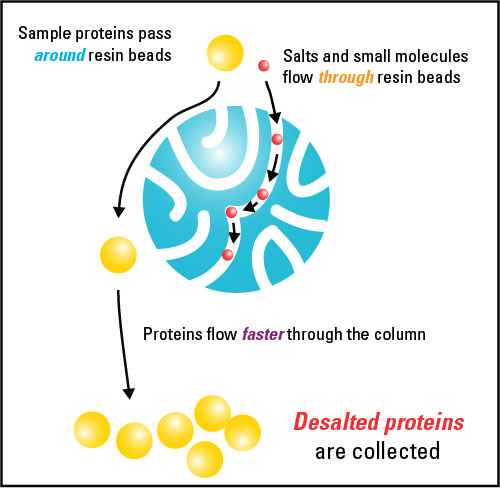
タンパク質 protein、ペプチド peptide、核酸 nucleic acid などでも分離することができるし、分子量測定に用いることもできる (1)。さらに、タンパク質は塩よりも分子量が著しく大きいので、脱塩やバッファー交換にもゲル濾過を使うことができる。
実際にゲル濾過を行う前には、
- 担体
- カラム
- 流速
- サンプル量
などを決める必要がある。
担体の選択
実際にゲル濾過に使う担体を選ぶためには、まず目的をはっきり意識することが重要である。大まかに
- 脱塩、バッファー交換
- タンパク質の精製
- 分子量の測定
に分けることができる。まず GE Healthcare のゲル濾過担体 Sephadex G-75 のページ を参考に、担体の重要なパラメーターを一覧にしておく。とくに
| パラメーター | 意味 |
|---|---|
マトリックス |
担体を構成する分子。Sephadex G-75 は cross-linked dexatran からできている。 |
粒子サイズ |
Wet 90 - 280 µm, dry 40 - 120 µm。水につけると担体は膨潤する。 |
| pH 安定性 | 2 - 10。一般に、ゲル濾過担体は広い pH で安定である。 |
流速 |
Darcy's law 以下の流速でビーズは安定であると書かれている。 |
Pressure/flow specidication |
min 90 cm/h, bed height 10 cm, column 5 cm i.d. |
分画分子量 |
球状タンパク質では 3 x 103 - 8 x 104、つまり 3 - 80 kDa。デキストランの場合は 1 x 103 - 5 x 104 と低い方へシフトする。 |
|
この分子量よりも大きい分子は分離されずに、まとまって溶出されるという分子量の値 (1)。Sephadex G-75 では > 70 kDa (球状タンパク質で 3,000 - 80,000 という資料もある) なので、これより大きいタンパク質は分離されないことになる。 原理は単純で、大きすぎる分子は全て担体と相互作用せずに通過することによる。 |
排除限界の逆。小さすぎる分子は、担体に完全に浸透しきってしまうため、ほぼ同じ位置に溶出する。 たとえば、水とエタノールの混合溶媒を流したとき、カラムの中で水とエタノールが分離されてしまっては困るが、浸透限界があるためにそのようなことは起こらない。 Sephadex G-75 では約 3,000 となっているが、これより小さくても全く分離されないということはなかった (参考: サイズ排除クロマトグラフィーによる loading dye の分離実験)。 |
|
保存条件 |
4 - 30°C。高温にもかなり安定。Wet form はオートクレーブも可能。 |
ゲル濾過では、サンプル濃度によって分離能が左右されることはない (2)。ただし、粘性が上がると分離能は低下する。一方、サンプルの液量が増えると分離能は低下する。脱塩ではカラム体積の 30% 前後、精製では
ゲル濾過クロマトグラフィーの実際
この項目では、実際の論文を例にゲル濾過クロマトグラフィーの使用例をまとめる。単なる精製目的での使用例はたくさんあるので、ちょっと変わった方法が中心になるだろう。
タンパク質 - タンパク質相互作用の証明
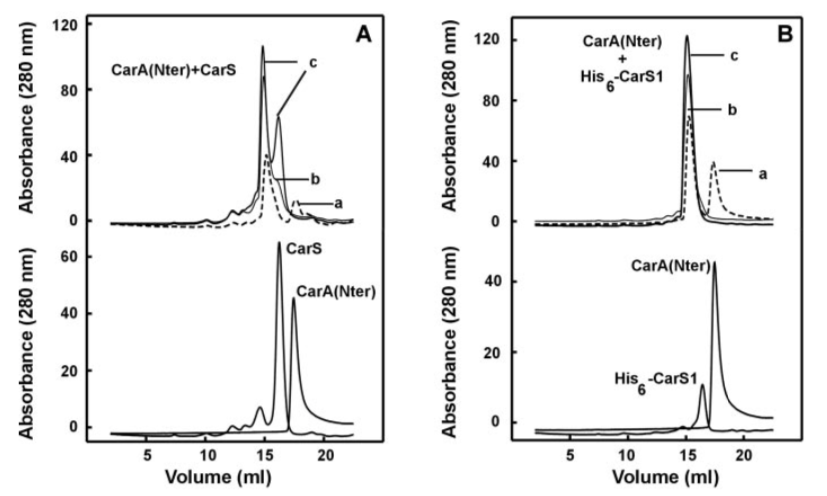
Perez-Marin et al. (2004a; Ref 3) は、CarA および CarS というタンパク質の相互作用をゲル濾過を使って証明している。下のパネルは CarA の N 末端部分および CarS をそれぞれ単独で流し、elution pattern をマージしたもの。上のパネルは mix。大きい分子量のピークが現れていることで結合を証明。それぞれの分子量も正確に計算している。
Legend ともう少し詳しい解説は ブログに。
タンパク質 - DNA 相互作用の証明
> Ecdysteroid receptor と DNA の相互作用、方法論の論文 (4)。
- EMSA は、泳動中のタンパク質-DNA 結合の強さが鍵になる。Ecdysteroid receptor は凝集する性質があるので、塩濃度が低いと EMSA が成り立たない。
- ゲル濾過は、EMSA に比べて buffer を自由に設定できるというメリットがある。単に結合を証明できるだけでなく、stoichiometry まで可能。
- 一般に、転写因子との結合実験に使う DNA は二本鎖。DNA 競合、saturation するか、分子量なども調べている。
References
- ゲルろ過クロマトグラフィー 担体選択のポイント. GE ヘルスケア Link.
- バイオダイレクトメール No 24. タンパク質を大きさで分ける サンプル調製のポイント. Link.
Perez-Marin et al. 2004a. The N terminus of Myxococcus xanthus CarA repressor is an autonomously folding domain that mediates physical and functional interactions with both operator DNA and antirepressor protein. J Biol Chem 279, 33093-33103.Ozyhar and Kilts 1991a. High-resolution gel filtration of the ecdysteroid receptor-DNA complex - an alternative to the electrophoretic mobility shift assay. J Chromatogr 587, 11-17.- By Potcherboy - Own work, CC BY-SA 3.0, Link.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
