グルコースが重合してできた貯蔵糖質 グリコーゲン:
構造、合成、分解など
UBC/aa_carbo_lipid/carbohydrate/glycogen
このページの最終更新日: 2025/11/23- 概要: グリコーゲンとは
- グリコーゲンの合成
- グリコーゲンの分解
- グリコーゲンホスホリラーゼ
- トランスフェラーゼ
- ホスホグルコムターゼ
- G6P (グルコース-6-ホスファターゼ)
広告
概要: グリコーゲンとは
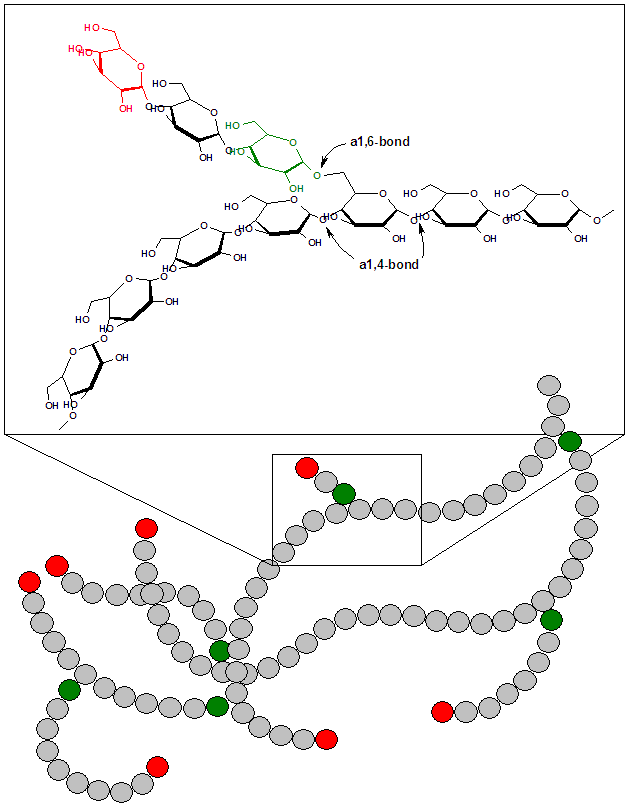
グリコーゲン glycogen とは、グルコース glucose が α-1,4- および α-1,6-グリコシド結合 glycosidic bond によって重合した高分子で (図, Public domain)、動物の主要な貯蔵糖質である。
> α-1,6-glycosidic bond が入るところで分岐する (2)。
- 分岐はおよそ 10 のグルコースにつき 1 回入る。13 個につき 1 回としている文献もある (4I)。
- α-グリコシド結合は、セルロースを構成する β-グリコシド結合よりも折れ曲がっている。
- ゆえにセルロースはグリコーゲンよりも繊維状である。
- 枝分かれのメリットは、溶解度と分解の効率が上がること。様々な酵素がアクセスしやすくなっている。
グリコーゲンの分布
哺乳類 では、主なグリコーゲン貯蔵組織は肝臓および骨格筋である (2)。
グリコーゲン量は状況によって変動するが、一般には重量比で肝臓の 6 %、筋肉の 1 %程度である (1)。肝臓の方が割合が高いが、組織の総重量は筋肉が著しく多いので、グリコーゲン蓄積量が最も多いのは筋肉になる。
細胞質に直径 10 - 40 nm の顆粒の形で存在する。
> 肝臓グリコーゲン量の低下が、血糖値やインスリン量とは関係なく脂肪分解 活性化することを示した論文 (5)。
- マウスを使用、「liver-brain-adipose neural axis を活性化する」という言葉を使っている。
- グリコーゲンの量自体が、栄養状態を感知するシグナルとして働いている。グリコーゲンの枯渇は糖質が足りない状況を表しているので、脂肪組織に作用して代謝を糖質から脂質へシフトさせている。
- Introduction の参考文献がわずか 1 個という珍しい論文。内容が specific であればこういうのもありなのか。
広告
グリコーゲンの合成
グルコースをグリコーゲン鎖の末端に付加するためには、uridine-diphosphate (UDP) と結合させ、活性化された状態にしなければならない (2)。UDP-glucose はグルコース-1-リン酸 glucose-1-phosphate (UDP) と UTP から作られる。
Glucose-1-phosphate + UTP → UDP-glucose + PPi
リン酸基が 2 つ外れることに注意する。グリコーゲン合成は
Glycogen + UDP-glucose → Glycogen (1 残基長い) + UDP
である。この反応は
Glycogen synthase は、4 残基以上の既存の glycogen を伸長する酵素 (2)。α-1,4-グリコシド結合のみを作る。α-1,6-グリコシド結合による枝分かれは branching enzyme が作る。
> Glycogen synthase は PKA および GSK にリン酸化され、不活性化する (2)。
- GSK は glycogen synthase kinase。インスリン によって活性化される (2)。
- グリコーゲン分解の glycogen phosphorylase は、PKA によって活性化する。
- つまり、PKA は合成の停止と分解の開始を同時に行う。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
グリコーゲンの分解
グリコーゲンの分解は、以下の 3 つの段階から成る (2)。4 つの酵素 enzyme が必要である。
- グリコーゲンからグルコース-1-リン酸 glucose-1-phosphate (G1P) が遊離する。
- グリコーゲンは、さらなる分解のために構造変化を起こす。
- G1P がグルコース-6-リン酸 glucose-6-phosphate (G6P) に変換される。
グリコーゲンホスホリラーゼ
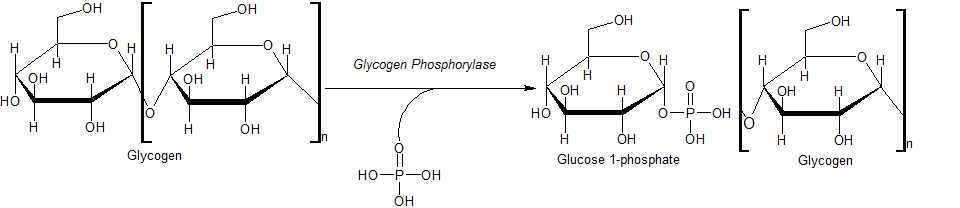
グリコーゲンホスホリラーゼは、グリコーゲンに無機リン Pi を付加して G1P を遊離させる酵素である (1、図は文献 3)。この酵素は、リン酸化と AMP による制御を受けている。
Glycogen + Pi → Glucose-1-phosphate + Glycogen (1 残基短い)
トランスフェラーゼ
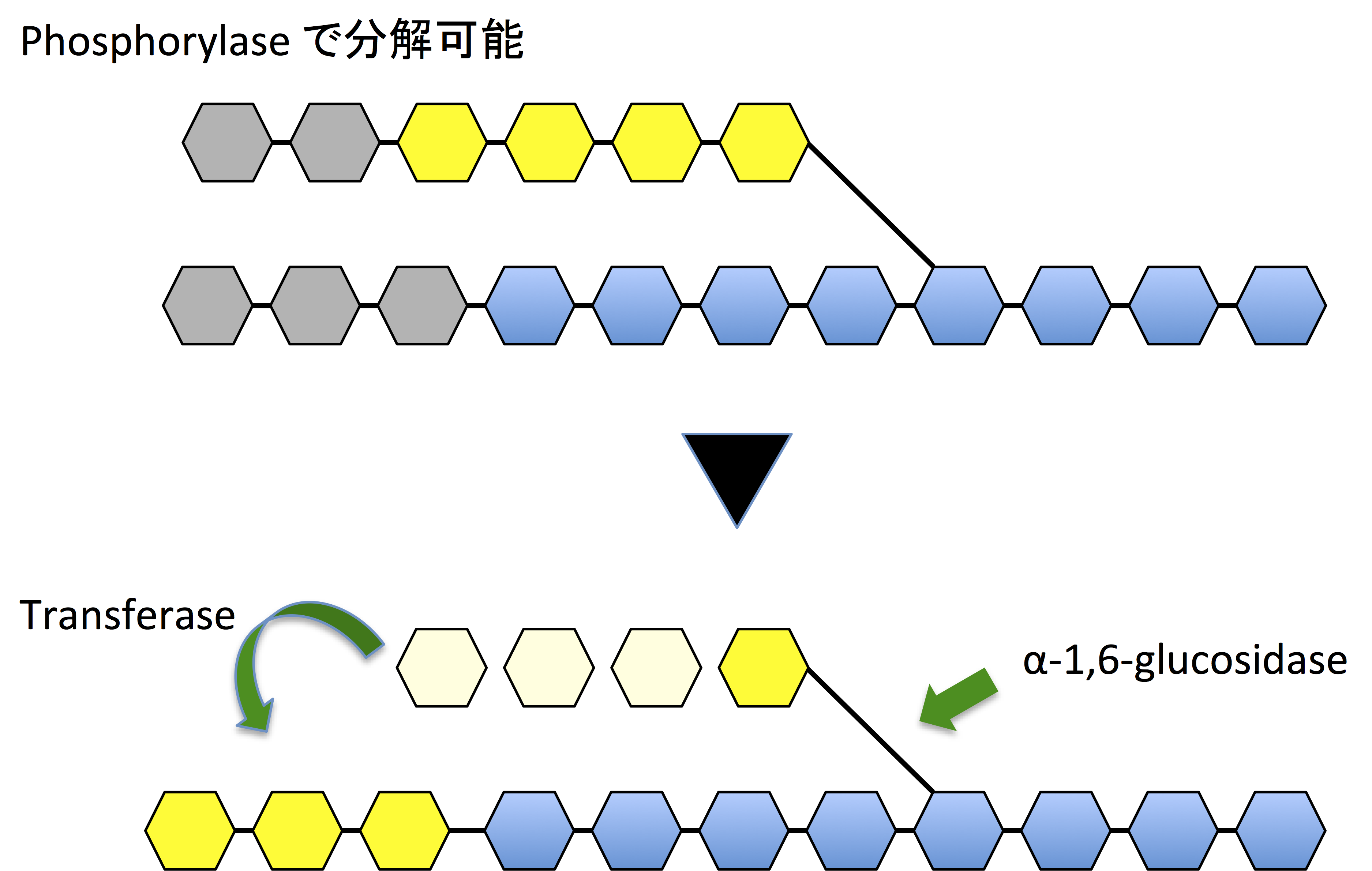
Glycogen phosphorylase は α-1,6-グリコシド結合を切ることができない。また、α-1,6-グリコシド結合による分岐があると、その 4 残基手前で α-1,4-グリコシド結合の切断も止まってしまう (2)。
その場合、transferase が 3 つの残基を下の図のように移し替えることで、α-1,4-グリコシド結合が切断されるようになる。1 個だけ残った α-1,6-グリコシド結合による分岐は、α-1,6-glucosidase で切断される (1)。これは加水分解であり、G1P でなくグルコースが生じる。
Transferase と α-1,6-glucosidase は、1 本のポリペプチド上に存在する bifunctional enzyme である (1)。
ホスホグルコムターゼ
G1P を G6P に変換する酵素は
G6P
G6P は 解糖系 の中間体である。多くの生物では、ヘキソキナーゼ がグルコースをリン酸化する解糖系の最初の反応で生じる。G6P は、原則として以下の 4 つのいずれかの運命をたどる。
- 解糖系で代謝される。
- ペントースリン酸経路 に入る。
- グリコーゲン合成に使われる。
- グルコースに脱リン酸化され、血液中に放出される。
グリコーゲンが分解されるような状況では、細胞はややエネルギー不足の状態に陥っていると考えられる。よって、グリコーゲン由来の G6P は 1 の運命をたどることが多いだろう。
肝臓と腎臓は、血液を介して他の臓器にグルコースを供給するという役割ももっている。その場合、G6P は 4 の運命をたどる。G6P からリン酸基を取り除く酵素は
糖新生のページ でも見たように、G6P はリン酸基のもつ電荷のために 細胞膜 を透過しにくいが、グルコースは GLUT により細胞外に受動輸送される。したがって、肝臓と腎臓が血液中にグルコースを放出することと、肝臓と腎臓でグルコース-6-ホスファターゼが発現していることはよく対応する。
広告
References
- Amazon link: ハーパー生化学 30版.
Berg et al. 2006a. (Book) . Biochemistry, 6th edition.
|
Berg, Tymoczko, Stryer の編集による生化学の教科書。 巻末の index 以外で約 1000 ページ。 正統派の教科書という感じで、基礎的な知識がややトップダウン的に網羅されている。その反面、個々の現象や分子に対して生理的な意義があまり述べられておらず、構造に偏っていて化学的要素が強い。この点、イラストレイテッド ハーパー・生化学 30版 英語圏ならば学部教育向けにはややレベルが高い印象。しかし、基本を外さずに専門分野以外のことを |
- By Jmun7616 - 投稿者自身による作品, パブリック・ドメイン, Link
Zang et al. 1991a. Assignment of the 1H chemical shifts of glycogen. Carbohydrate Res 220, 1-9.Izumida et al. 2013a. Glycogen shortage during fasting triggers liver–brain–adipose neurocircuitry to facilitate fat utilization. Nat Commun 4, 2316.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
