ミオグロビン: 筋肉の酸素貯蔵分子
UBC/protein_gene/m/myoglobin
このページの最終更新日: 2025/10/04- 概要: ミオグロビンとは
- ミオグロビンの構造
- ミオグロビンと酸素の結合
- ミオグロビンその他
広告
概要: ミオグロビンとは
ミオグロビン myoglobin は筋肉中に存在し、酸素を貯蔵する約 17 kDa のタンパク質である。マグロ、牛肉などの赤い色はミオグロビンに由来する。
Sperm whale myoglobin は、1950 年代に最初に結晶構造解析がなされたタンパク質である (1)。
ヒトのミオグロビン
ヒト には 1 個のミオグロビン遺伝子があり、22 番 染色体 上に位置している。複数のアイソフォームがあるようだ。Isoform 1 (NP_001349775.1) は 154 アミノ酸から成り、分子量 は 17183.81、等電点は 7.14 である。
ミオグロビンの構造
ミオグロビンの構造で重要なのは、酸素と結合するヘム heme の部分 (図, Public domain) の部分である。なお、英語では「ヘム」ではなく「ヒーム」[hiːm] と発音する。
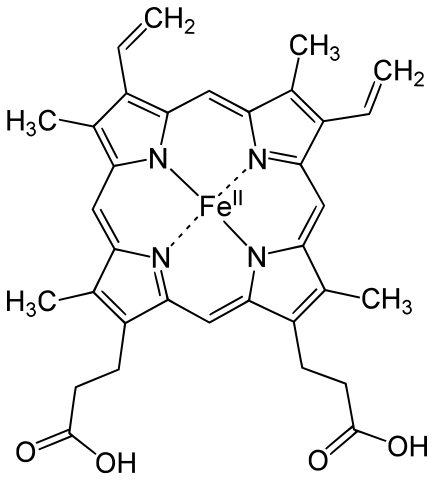
ヘムの重要な性質は以下の通り。
- 中央の鉄 iron 原子で酸素と結合する。
- 血液 blood や筋肉 muscle に特有の赤色の原因。
鉄以外の部分を
ミオグロビンと酸素の結合
ヘムに含まれる鉄原子は 6 つの結合サイトをもつ (1)。うち 4 つは上の図に見るように窒素原子との結合に使われており、さらに 1 つはミオグロビンに含まれるヒスチジン histidine 残基のイミダゾール基との結合に使われている (参考: 官能基の一覧)。このヒスチジンは
残った 1 個の結合サイトには、酸素が結合することができる。酸素と結合していない状態は deoxymyoglobin, 結合した状態は oxymyoglobin と呼ばれる。
鉄原子の価数とメトミオグロビン
鉄原子は 2 価の Fe2+ と 3 価の Fe3+ の陽イオンになることができる。通常は Fe2+ の状態であり、最外殻電子数は 0 である。ここに 2 個の最外殻電子をもつ酸素が 配位結合 する。
このまま酸素が解離すれば問題ないのだが、解離の際に
> ヒトの多くのガン組織で myoglobin が発現していることを示した論文 (3)。
- Mb は酸素のリザーバーしての機能の他、その高い酸素親和性から ROS scavenger としてもはたらく。
- また、低酸素条件下で誘導されることも知られている。そこで、ガン組織で Mb の発現を調べた。
- 多くのヒトガン組織由来のcell lineを用いた実験。
- Mb mRNAをリアルタイムPCRで検出。Proteinを免疫染色で検出。
- Hypoxia, H2O2, SNAP (S-nitroso-N-acetylpenicillamine; 酸化ストレス誘導剤), EGF による誘導を MCF-7 で ウエスタンブロット により検出。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
ミオグロビンその他
> Bison のミオグロビンを精製し、性状解析を行った論文。
- Bison は食用にされ、肉も脂質含量が低く健康的。しかし、肉の色が牛よりも早く悪化する。そこで Mb を精製し、その性状をウシ Mb と比較した。
- 一次構造は 100% 同じだった。メト化などの性状を調べたが、beef Mb との違いはみつからなかった。
- したがって、Mb の性状以外の原因があると考えられた。PUFA 代謝産物である HNE や、抗酸化酵素活性などを挙げている。
ミオグロビンの立体構造 (Public domain)。
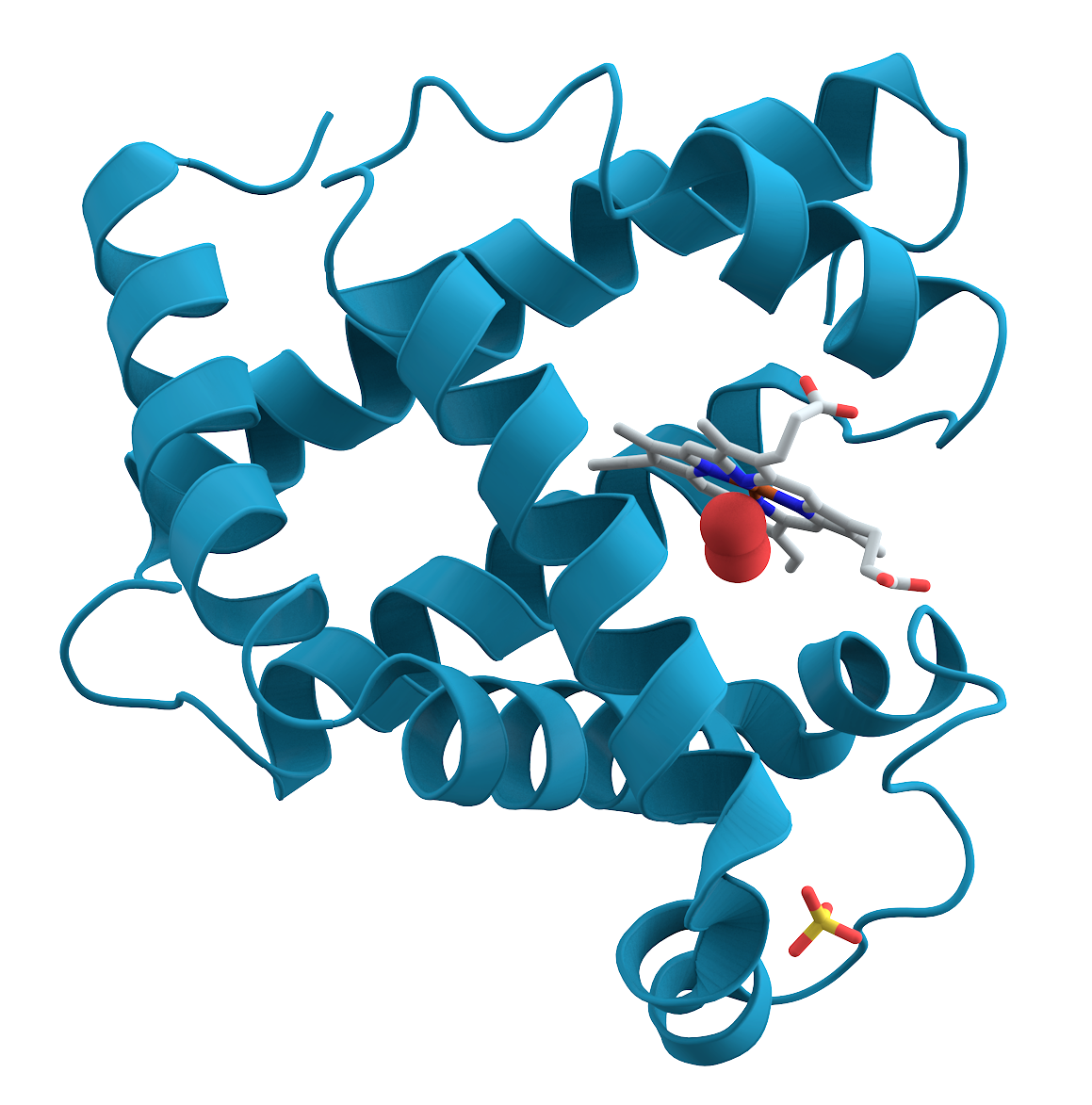
References
- Amazon link: ストライヤー生化学
: 使っているのは英語の 6 版ですが、日本語の 7 版を紹介しています。参考書のページ にレビューがあります。
- By Yikrazuul - 投稿者自身による作品, パブリック・ドメイン, https://commons.wikimedia.org/w/index.php?curid=11081791
Flonta et al., 2009a. Expression and functional regulation of myogenin in epothelial cancers. Am J Pathol, 175, 201-206.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。

