ヒスチジンの構造、機能、代謝:
イミダゾイル基・酵素の活性中心
広告
概要: ヒスチジンとは
ヒスチジン His は図のような
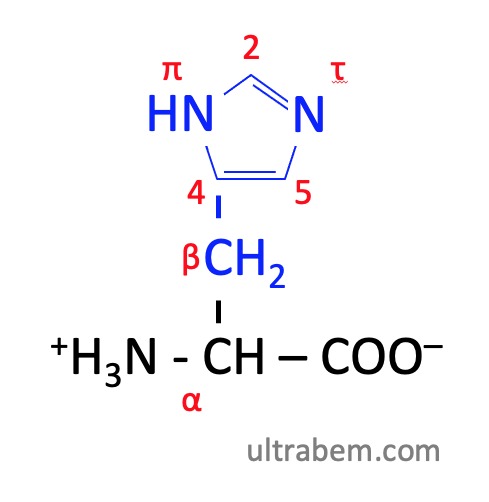
- pK1 (COOH) = 1.8
- pK2 (NH3+) = 9.3
- pK3 (側鎖) = 6.0
- 必須アミノ酸
- 赤の数字は炭素番号で、His のそれは非常に特殊である (5)。アミノ酸の炭素番号 のページを参照のこと。
岩波 理化学辞典 (Amazon) より、物理化学的性状など。
- L 体は柱状結晶、融点277度 (分解)。
強塩基性 で、酸と反応して塩をつくる。- ジアゾベンゼンスルホン酸 or 臭素水で赤色を呈する。
- 腐敗により ヒスタミン histamine を生ずる。
ヒスチジンは ヘモグロビン、スツリンなどに多く含まれていて、それらの加水分解で得られ、また合成もされる。1896 年に Albrecht Kossel および Sven Hedin によって独立に発見された。
ヒスチジンの共鳴構造
ヒスチジンのイミダゾール基には、2 個の 窒素原子 が含まれている。直鎖状部分に結合している炭素の隣にあるものと、間に 1 個炭素を挟んでいるものである。
上の図では、直鎖状部分に近い N に水素が結合しているが、これは下の図 (Ref 4) のような
さらに、このページの下で解説しているように、両方とも H と結合して NH および NH+ になることができ、これがヒスチジンの性質上とても重要である。
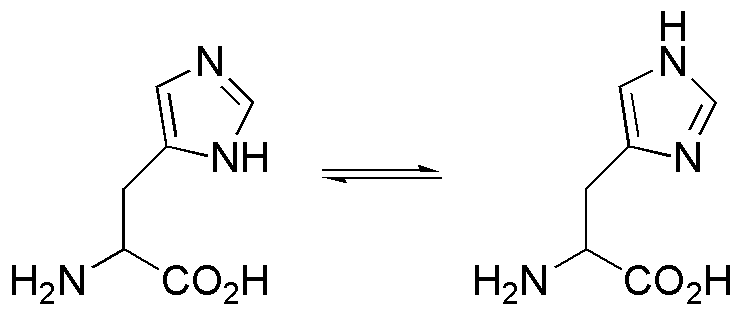
ヒスチジンは芳香族アミノ酸か?
Oxford Dictionary of Biology には芳香族アミノ酸 aromatic amino acid という項目はないが、シキミ酸経路の項目で "aromatic aminos - tyrosine, phenylalanine, and tryptophan -" という表現があり、ヒスチジンは含まれていない (3)。
イラストレイテッド ハーパー・生化学 30版 (Amazon link) にはアミノ酸の一覧の表があり、His は「芳香族環を側鎖にもつアミノ酸」に含まれている。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
ヒスチジンの特徴
ヒスチジンの性質は、側鎖にあるイミダゾール基の性質に由来することが多い。上の図には書いていないが、
金属イオンと配位結合する
ヒスチジンと金属イオンの相互作用は、1948 年に初めて観察された (2)。この性質のため、ヒスチジンは発現タンパク質のタグとして使われる (参考: ベクター構築関係の用語集)。
溶出するときには、過剰量のイミダゾールを加えることで金属イオンと His tag の結合を競合阻害する。または、溶液を酸性 (pH < 4.5) にすると His がプロトン化され、Ni と相互作用しなくなるため、酸性溶液で溶出することもできる (プロメガ MagneHis プロトコール, Link; Pdf file)。
6 x His tag をつけると、等電点は上がる。タンパク質の大きさなどにもよるが、0.1 - 0.5 ぐらいは変化する。二次元電気泳動 をするときには気を付けよう。
酸にも塩基にもなる: His が酵素の活性中心にある理由
ヒスチジンに含まれるイミダゾール基は
「H+ を放出するのが酸、受け取るのが塩基」という 酸・塩基の定義 によると、His は生理的 pH (pH 7 前後) で酸にも塩基にもなれるアミノ酸であるということになる。
また、H+ を受け取るとヒスチジンは正電荷を帯びることから「ヒスチジンは約 pH 6 以下で正電荷を帯びる」と表現することもできる。
この特徴は、酵素 enzyme による触媒反応を考えたときに極めて重要である。
酵素が触媒する多くの反応で、H+ の放出や吸収が起こる。したがって、H+ を簡単に供給したり受け取ったりできる物質が反応部位の近くにあることが望ましい。His はこの目的に適ったアミノ酸であり、多くの酵素が活性部位に His をもっている。
ヒスチジンの生合成および欠乏症
ヒスチジンの生合成は、プリンおよびピリミジンと同様に phosphoribosyl pyrophosphate (PRPP) を起点とする。さらに 10 以上の反応を介する複雑な経路である (6)。
ATP phosphoribosyl transferase (ATP-PRT) が最初の反応を触媒する。第二の反応は phosphoribosyl-ATP pyro phosphatase に触媒され、これは phosphoribosyl-AMP (PR-AMP) を生じる不可逆的な加水分解反応である。第三に、PR-AMP cyclohydrolase がプリン環を開環し、1-(5-phosphoribosyl)-5-[(5-phosphoribosylamino) methylideneamino] imidazole-4 carboxamide (5′ProFAR) を放出する。
第四の反応は 5′ProFAR isomerase によって触媒される。第五の反応は PRFAR の変換であり、imidazoleglycerol-phosphate dehydratase によって触媒される。第六反応の説明は追加予定。
第七の反応は IAP の transamination であり、グルタミン酸がアミノ基のドナーとして使われる。第八の反応では、Hol-P が脱リン酸化され l-histidinol が生じる。第九および第十の反応は、一つの酵素によって触媒される。
ヒスチジンはヒスタミンの原料であるため、欠乏すると免疫反応に障害が起きる恐れがある。湿疹がみられることが多い。
His の分解
His は直接 Glu に変換されるタイプである (1)。
酵素 formimidoyltransferase cyclodeaminase が必要。原核生物では、ヒスチジンは最初に histidase によって urocanate に変換され、次に urocanase によって 4-imidazolone-5-propionate になる。さらに imidazolonepropionase これを formiminoglutamate (FIGLU) にし、formimino group が tetrahydrofolate に移される。残った 5 つの炭素がグルタミン酸になる。
広告
References
Berg et al. 2006a. (Book) . Biochemistry, 6th edition.- 生化夜話 第33回:観察から実用化まで40年 - Hisタグ. Link.
- Amazon link:
Hine (2015). Oxford Dictionary of Biology.
- By Calvero. - Selfmade with ChemDraw., パブリック・ドメイン, Link
IUPAC-IUB Joint Commission on Biochemical Nomenclature, 1984a. Nomenclature and Symbolism for Amino Acids and Peptides. Eur. J. Biochem. 138. 9-37. Link: Last access 2018/07/25.Kulis-Horn et al., 2014a. Histidine biosynthesis, its regulation and biotechnological application in Corynebacterium glutamicum. Microb Biotechnol 7, 5-25.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
