脂質を組織に分配する酵素:リポタンパク質リパーゼ
UBC/protein_gene/l/lpl
このページの最終更新日: 2024/02/14広告
概要: リポタンパクリパーゼとは
いわゆる「脂肪」である トリアシルグリセロール は、グリセロール 1 分子と脂肪酸 3 分子がエステル結合した分子である (図、Public domain)。脂肪組織 や 肝臓 にエネルギー源として貯えられており、必要に応じて筋肉などに血液を介して輸送される。
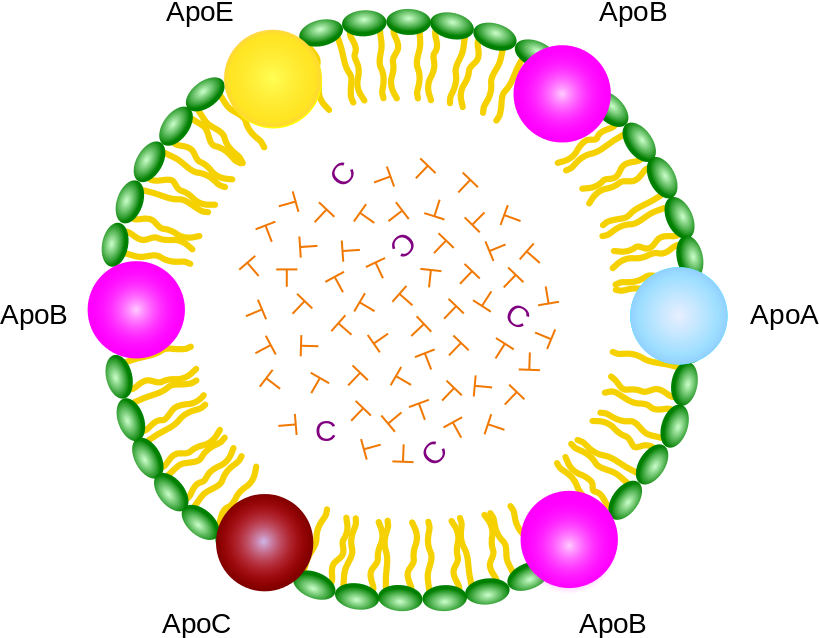
トリアシルグリセロールの水溶性は非常に低いため、血液を介した輸送の際には、タンパク質やリン脂質の複合体であるリポタンパク質 lipoprotein として存在する (リポタンパク質の模式図、文献 14)。
しかし、リポタンパク質はそのままでは細胞膜を通ることができないため、細胞に取り込まれる際には以下の2つのいずれかの方法をとる必要がある。
- 脂肪酸部分が リポタンパク質リパーゼ lipoprotein lipase (LPL) による加水分解で切り離され、生じた遊離脂肪酸が脂肪酸トランスポーターを通して取り込まれる。
- リポタンパク質が細胞膜上の受容体に結合し、受容体ごとエンドサイトーシスされる。
LPL (EC 3.1.1.34) は 1 の加水分解を触媒する酵素である。
したがって、非常にシンプルに言えば、
また、2 の反応においてもリポタンパク質の認識に関わるリガンドとしての役割を果たしている (11)。
脂質を血液から細胞内へ移行させるのが基本的な機能であるため、血中脂質が高い状態で働くと考えられる。インスリン による制御が有名である。
広告
リポタンパク質リパーゼの構造
LPL 自体の立体構造解析は行われていないが、膵臓リパーゼ pancreatic lipase の構造をもとに議論がなされている。大きく N 末端ドメインと C 末端ドメインに分かれる。
N 末端ドメインは酵素の活性に、C 末端ドメインは基質特異性に寄与するところが大きいと考えられている。
活性中心 |
他のリパーゼ Pancreatic lipase (PL), hepatic lipase (HL), endothelial lipase (EL) などとともに、GXSXG motif の中にある Ser が活性中心である (11)。 Ser-Asp-His がよく保存された catalytic triad である (11)。 |
| ヘパリン結合サイト | Ref. 4. ヘパリン結合のコンセンサス配列 [B-B-X-B] または [B-X-B-B-X-X-B] に従う。 |
| ダイマー形成 | ヒト LPL では、415 - 438 番目のアミノ酸が、基質との結合およびダイマー形成に必要である (2R)。この領域には、よく保存された疎水性アミノ酸の連続領域が2ヶ所あり、基質結合部位と思われる。9種の変異体を HEK293 で発現させ tributylin (水溶性)、triolein (脂溶性)基質の分解をテスト。基質の特性や、酵素の安定性が変化した。ダイマー形成にも影響していると考えられた。 |
| ジスルフィド結合 | ヒト LPL では、10 個の Cys が、5 組のジスルフィド結合を形成し、構造の安定性に寄与する (8)。ニジマスの LPL では C-terminal domain の1組が欠けている。体温が低いために、酵素がフレキシブルな構造になっていると考えられる。ニジマス LPL は、実際に37℃で処理したときの活性低下がウシ LPL よりも著しい。 |
リポタンパク質リパーゼの酵素活性
LPL は、TAG に富むリポタンパク質であるキロミクロン、VLDL 中の TAG を NEFA と 2-モノアシルグリセロールに加水分解する (1I)。生成したNEFA は、例えば脂肪組織では再エステル化されて再び TAG として保存され、筋肉では β 酸化されてエネルギー源になる。
TAG の sn-1 位を優先的に加水分解する。ジアシルグリセロール DAG も加水分解でき、やはり sn-1 位が優先される。1 M オーダーの NaCl で酵素活性が阻害される。
14C で標識したトリオレイン (オレイン酸が3個ついているトリアシルグリセロール TG)を基質として、LPL の酵素作用によって遊離した 14C-オレイン酸の存在量を測定する方法が古い文献ではよく使われている。この反応を触媒する酵素は他にもあるが、1 M NaCl で活性が阻害されるのが LPL の特徴であるため、これを利用して LPL の活性を算出することができる。3 mg/ml protamine sulfate でも活性が阻害される。
各組織での機能、発現パターン
脳
成体ラットの脳で酵素活性が検出されている (9)。14C-トリオレインを基質として、1 - 2 nmol/min/g の活性が得られている。
一般に、LPL の基質である TG-rich lipoprotein は血液脳関門を通過できないため、脳での LPL の機能には未知な点が多い。ただし、病気などで BBB が損傷した場合には、血中のリポタンパク質が脳に侵入することがわかっている (3D)。
ラット caudap spinal cord には、筋肉や脂肪組織と同等の酵素活性が存在する (10R)。小脳 cerebellum での活性がやや高く、10 nmol/min/g。他の脳部位では 3 未満が多い。mRNA は海馬 hippocampus で多く、視床、大脳皮質、下垂体でも Northern で検出される。免疫染色したところ、多くは脳の血管で発現。しかし gray matter をはじめ様々な部位も染まる。LPL活性が異なるのに、食べた14C-オレイン酸の取り込み量は脳の各部位で均一である。
Pyramidal cell layer of hippocampus, Purkinje cells of the cerebellum およびその他 (Paradis et al. 2003a. Lipoprotein lipase affects the survival and differentiation of neural cells exposed to very low density lipoprotein. J Biol Chem 278, 9698-9705.)。
神経細胞 neuron で発現させたLPL は、ヘパリンまたは VLDL を培地に添加することで遊離する (3R)。VLDL と硫酸銅を培地に加えたあとの生存率は、LPLを発現させた細胞の方が高い。一方、過酸化 VLDL への感受性は LPL 発現細胞の方が高い。おそらく LPL が結合を増やすため。総じて、LPL を神経に発現させても、末梢と同じ機能を果たすことがわかった。神経系が損傷すると VLDL に曝されるため、LPL は損傷からの回復に重要である。
神経特異的 LPL-deficient mice は、chow-fed diet 飼育下で食欲増進と肥満 obesity を示す (Wang et al. 2011a. Deficiency of lipoprotein lipase in neurons modifies he regulation of energy balance and leads to obesity. Cell Metab 13, 105-113.)。ただし、この論文では LPL 活性がほとんど低下していない点に注意すべきである。 代謝と physical activity も低下する。14C-オレイン酸を含むキロミクロンを注射すると、14C脂肪酸は視床下部に LPL 依存的に到達した。これは、視床下部の一部は BBB がないことを反映していると考えられる。食欲増進作用のある AgRP, NPY などの発現が視床下部で増大していた。したがって、視床下部は脂肪酸を LPL 依存的にモニターし、食欲制御を行っていると思われる。
肝臓
ラット肝臓では、新生児のみで mRNA 発現がみられる。成体では mRNA が発現しない (5)。悪液質 cachexia (6)のときは、成体の肝臓でも発現がみられる。
腎臓
腎臓では LPL 活性が高いが、脂肪酸取り込みは少なく、血中 FFA pool を作っているかも (2, 14R)。
ミンク、ハムスター、マウス、ラット、モルモットの各組織の LPL 活性が測定されている。マウス腎臓の LPL 活性はサーカディアンリズムに従う。脂肪組織でも論文があるらしい。マウス腎臓の LPL 活性は、6時間から48時間の絶食期間中低下する。mRNA 量は変化しない。ヘパリン投与によって、マウス腎臓の LPL 活性は約 49% に低下。心臓ではあまり変化しない。
リポタンパク質リパーゼ LPL の発現調節
5' 上流域の配列 cis-element、Bey et al. 1998a. Cloning, sequencing and structural analysis of 976 base pairs of the promoter sequence for the rat lipoprotein lipase gene. Comparison with the mouse and human sequences. Gene 209, 31-38.
Rat で 976 bp の配列を決定し、ヒトおよびマウスの相同領域と比較した論文。脂肪細胞分化の過程で、aP2, GDP, LPL の発現はが突然低下する。cis-element FSE-2は、この発現抑制に関わっていると報告されている。翻訳領域よりも保存性が低く、11.8%の違いがあった。翻訳領域では5.6%。
脂肪細胞および心筋が分化する際に、LPL の発現が増大する。GATA cis-element には GATA-4 が結合し、この発現パターンに寄与する (1D)。 ヒト、ラット、マウス LPL の上流域で共通してみられる (1R)。
食後には、血中インスリン濃度が増大し、筋肉 LPL mRNA の量が低下する。インスリンの作用を仲介する cis-element は未同定であるが、insulin response sequence (IRS) はインスリン応答性遺伝子に共通してみつかる配列である。
3T3-L1 で、1,25-dihydroxy vitamin D が LPL mRNA を増大させることがわかった (1D)。VDRE (vitamin D responsive element) は、これに関わる cis-element で、3 bp のスペーサーを含む CGGTGA の2回リピートから成る。
絶食の影響
絶食に対する LPL の発現や活性の変化は、様々な生物で調べられている。臓器ごとに応答が異なるのが特徴である。原則としては、脂肪組織から心臓および末梢への脂質輸送を促進する ために、脂肪組織で活性が下がり、心筋、骨格筋で活性が上がる。
肥満および通常ラットの WAT と BAT で、24 時間飢餓に対する LPL 活性の変化を比較した論文 (Llado et al. 1999a. Effects of fasting on lipoprotein lipase activity in different depots of white and brown adipose tissues in diet-induced overweight rats. J Nutr Biochem 10, 609-614.)。
WAT よりも BAT の方が LPL mass が多い。酵素あたりの specific activity は WAT の方が高い。 24 h starvation では、WAT LPL mass は減らないが specific activity が低下した。24 h starvation では、BAT LPL mass は変わらず、specific activity が上がった。過食で肥満になったラットでは、飢餓でむしろ WAT LPL activity が上がってしまった。Hyperinsulinemia のため、インスリンによる LPL の活性制御が破綻しているためと考えている。
Julve et al. 1996a. Hormonal regulation of lipoprotein lipase activity from 5-day-old rat hepatocytes Mol. Cell Endocrinol 116, 97-104.
Amri et al. 1996a. Fatty acids regulate the expression of lipoprotein lipase gene and activity in preadipose and adipose cells. Biochem J 314, 541-546.
その他メモ
> Familial LPL deficiency 患者のゲノム配列を解析した論文 (Ref)。
- 遺伝病の原因として、スプライシング異常はわりと一般的なものらしい。
- G to Aの置換は、スプライシング開始の配列である GT を AT にしてしまう。多くの遺伝病でみられる置換である。この置換がもたらす結果は多様。cryptic splice site, exon skipping, retention of an unspliced intron。
- 遺伝病患者のマクロファージRNAで、ホモの G to A 変異を発見。mRNA量が少なかった。
- 競合 PCR: 2種のcDNAから2種の遺伝子を同じプライマーで増やしてmRNA量の比を出す。変異によって、mRNA量が1/12になっていることを示している。
- 変異が入っている患者のLPLは、いろいろなところでスプライシングされている。正常な人でも、少しは missplicing が起こっていた。
広告
References
Shan et al. 2009a. The angiopoietin-like proteins ANGPTL3 and ANGPTL4 inhibit lipoprotein lipase activity through distinct mechanisms. J Biol Chem 284, 1419-1424.Keiper et al. 2001a. Novel site in lipoprotein lipase (LPL415–438) essential for substrate interaction and dimer stability. J Lipid Res 42, 1180-1186.Dugi et al. 1995a. Human hepatic and lipoprotein lipase: the loop covering the catalytic site mediates lipase substrate specificity. J Biol Chem 270, 25396-25401.van Tilbeurgh et al. 1994a. Lipoprotein lipase. Molecular model based on the pancreatic lipase x-ray structure: consequences for heparin binding and catalysis. J Biol Chem 269, 4626-4633.Merkel et al. 1998a. Lipoprotein lipase expression exclusively in liver. A mouse model for metabolism in the neonatal period and during cachexia. J Clin Invest 102, 893–901.Masuno et al. 1984a. Lipoprotein lipase-like activity in the liver of mice with Sarcoma 180. J Lipid Res 25, 419–427.Berg ed. 2006a (Book). Biochemistry, chapter 16. W.H. Freeman and Company, NY.Lindberg & Olivercrona 2002a. Lipoprotein lipase from rainbow trout differs in several respects from the enzyme in mammals. Gene 292, 213-223.Eckel & Robbins 1984a. Lipoprotein lipase is produced, regulated, and functional in rat brain. PNAS 81, 7604-7607.Bessesen et al. 1993a. Spinal cord of the rat contains more lipoprotein lipase than other brain regions. J Lipid Res 34, 229-238.Wong & Schotz 2002a (Review). The lipase gene family. J Lipid Res 43, 993-999.Morley et al. 1975a. Hydrolysis of diacylglycerol by lipoprotein lipase. J Biol Chem 250, 3414-3418.Augustus et al. 2003a. Routes of FA delivery to cardiac muscle: modulation of lipoprotein lipolysis alters uptake of TG-derived FA. Am J Physiol Endocrinol Metab 284, E331–E339.- By Xvazquez - Own work, CC BY-SA 3.0, Link
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
