細胞分裂、代謝、アポトーシスなどを制御する転写因子 Foxo: 構造、がんとの関係など
UBC/protein_gene/f/foxo
このページの最終更新日: 2025/11/23- 概要: Foxo とは
- Foxo の活性制御
- リン酸化による制御
- アセチル化による制御
- ユビキチン化による制御
- その他未整理
関連ページ
広告
概要: Foxo とは
Forkhead domain をもつ転写因子の一群をフォークヘッドファミリー forkhead family という (2I)。Forkhead family には A から Q まで 17 のサブファミリーがあり、A に対して B, C, D, ... の順に相同性が高い (1)。
Foxo とは、forkhead family の O サブファミリーに含まれるタンパク質の総称である。ヒト遺伝子は FOXO のように全て大文字で、マウスは Foxo のように最初だけ大文字で、他の生物は FoxO のように F と O のみ大文字で表す (1)。
哺乳類 の FoxO family には、Foxo1、Foxo3a、Foxo4 および Foxo6 の 4 種類が含まれる (1,9)。転写を促進する場合も抑制する場合もある (19)。
Foxo1 |
横紋筋肉腫 (rhabdomyosarcoma) の原因遺伝子として Pax3 との融合遺伝子の形で同定されたことから、当初は FKHR (forkhead in human rhabdomyosarcoma) と名付けられた。 Cell Signaling の抗体のページによると、分子量 は約 70 kDa。 Foxo1 の全身ノックアウトは胎生致死だが、他のアイソフォームのノックアウトではこれほど劇的な表現系が出ないため、Foxo1 が最も重要なアイソフォームと考えられている (18)。 > FOXO1 に関する日本語総説 (18)。主に変異体の表現系から。
|
Foxo3a |
これが C. elegans DAF-16 および Drosophila の dFOXO に相当する (7I)。 全身ノックアウトは、メスでは卵巣機能不全による不妊が見られるが、オスは正常である (18)。 |
Foxo4 |
ノックアウトしても表現系が観察されない (18)。 |
Foxo6 |
Akt によるリン酸化サイトを欠いており、特殊な細胞内局在を示す (1I)。 |
> マウス Foxo1, 3a, 4 の mRNA の分布はノーザンブロットで調べられている (13)。
- ほぼ全ての組織で検出され、肝臓で発現が低く、白色脂肪組織で高めなどの共通点がある。
- この論文では、Foxo 結合配列が TTGTTTAC という配列を共通して持っていることも示されている。
> Foxo1 のノックアウトについて (18)。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
Foxo の活性制御
リン酸化による制御
Akt によるリン酸化がもっともよく研究されている。Foxo1, 3a, 4 はいずれも Akt によってリン酸化され、転写活性を失う (10I)。
> マウス Foxo1 は
- マウスの肝細胞、インスリン 刺激を用いた実験。
- Ser253 に変異を入れると、インスリンによるリン酸化が完全に阻害される。
- 他の 2 残基では、部分的なリン酸化は起こる。したがって Ser253 が gatekeeperである。
- インスリン依存的なリン酸化はwortmanninで阻害されるため、PI3K 経路を通じたものである。
> ヒト FOXO1 は
- 生物種を指定せずにアミノ酸番号だけ書いている論文が多く、非常に困る。マウスの場合と同様、Ser256 が転写活性や局在の制御に重要。変異を入れたときの影響が最も大きい。
- 文献 20 では、3 つのリン酸化サイトに変異を入れ、DNA 結合などを調べている。
> 同じマウス Foxo でも、IGF 刺激ではリン酸化のパターンが異なる (5R)。
- マウス肝細胞では、Ser253がリン酸化されることで他の2つの残基がprimingされる。
- Thr24 はインスリン刺激でリン酸化されるが、IGF-I 刺激ではリン酸化されない。
- IGF-I 刺激では Foxo1 は核外に出ず、つまり Thr24 のリン酸化が局在を制御していると思われる。
Akt のほか、SGK, IKK, CDK2 によってリン酸化され、機能が阻害される (17)。また、活性化するキナーゼとしては JNK, MST1 などが知られており、これはストレス条件下でよく働く。
アセチル化による制御
少なくとも CBP [cAMP-response element-binding protein (CREB)-binding protein] によってアセチル化され、Sir2 によって脱アセチル化される (8)。図もこの論文から。p300 も Foxo をアセチル化する。
- アセチル化酵素でもある CBP によって Foxo1 と Foxo4 がアセチル化されると転写活性が低下 (8I)。
- Sir2 は Foxo1 を脱アセチル化し、転写活性を回復させる (8I)。細胞のストレス耐性が上がる傾向。
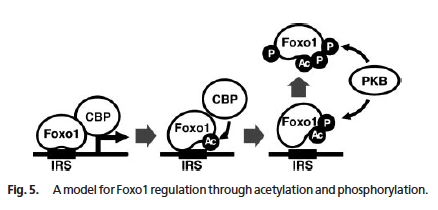
また、酸化ストレスによってもリジン残基がアセチル化され、核へ移行する (12I)。
一般に、アセチル化によって Foxo の DNA 結合能は低下する。DNA と結合している Foxo は Akt/PKB によるリン酸化を受けにくいため、アセチル化によって Foxo はリン酸化阻害を受けやすくなり、さらに DNA 結合能が下がる。
> 哺乳類では SIRT1 が酵母の Sir2 に最も近く、FOXO と関連が深い (12)。
- SIRT1 は、酸化ストレス条件下で FOXO3 と結合して脱アセチル化する。vitro でも vivo でも。
- 脱アセチル化は、全体に FOXO によってストレス耐性が獲得される方向に作用する。
- 例えば p27 の発現が上がって細胞周期が止まり、BIM が下がってアポトーシスが抑制されるなど。
ユビキチン化による制御
Foxo1 と Foxo3a は、ポリユビキチン化によって分解されるが、Foxo4 のモノユビキチン化は核への局在を促進し、転写活性を増大させる (18)。
その他未整理
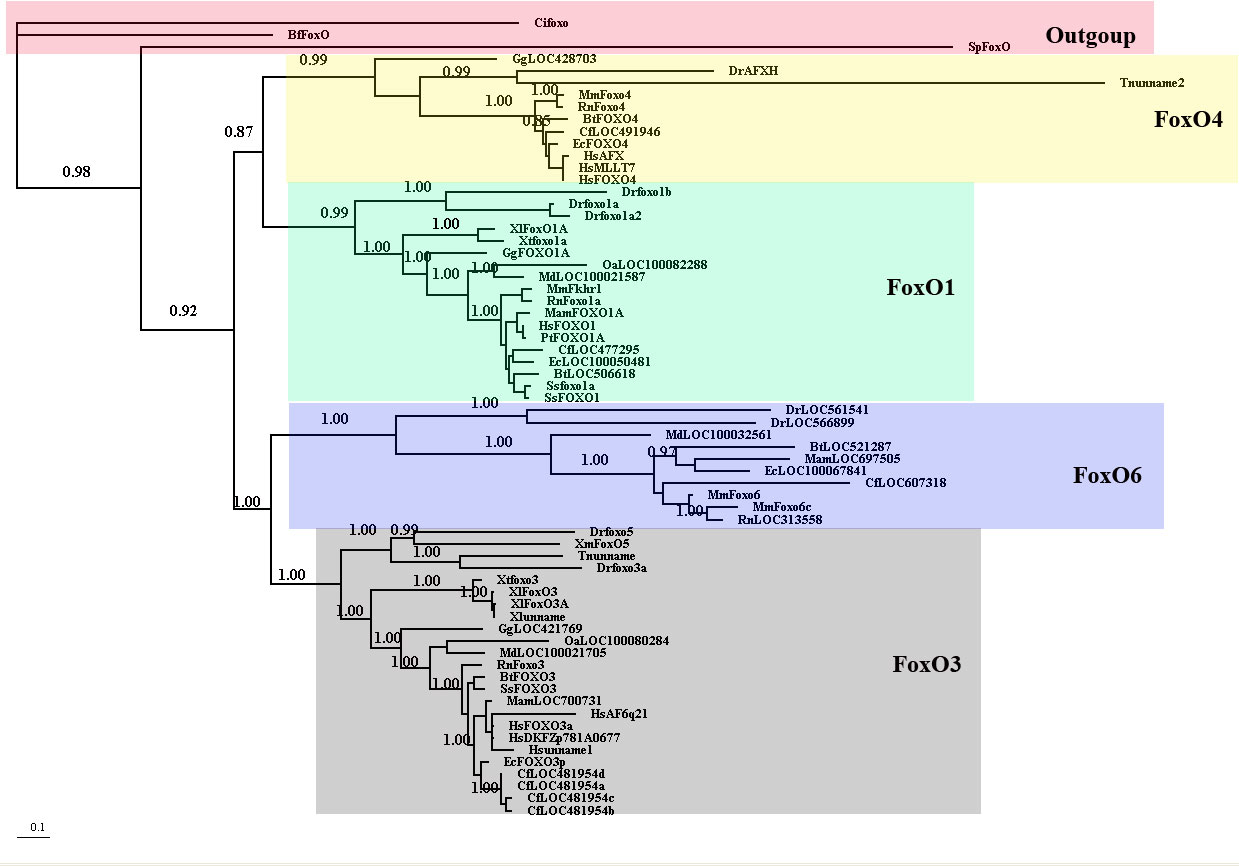
Foxo の分子系統 (3)。
ヒトの Foxo が長寿と関係しているという association study は、2012 年の時点で少なくとも 8 個ある (15I)。以下に示すマウス、Drosophila、C. elegansと同様に、寿命を延ばす作用があると考えられる。
> dfoxo null mutant は、野生型に比べて寿命が短い(16R)。
- ただし、カロリー制限やタンパク質制限に対する寿命の変化は野生型とほぼ同じである。
> Head fat body で dFOXO を発現する系統はオスもメスも寿命が長い(7R)。
- 酸化ストレス耐性も増大するが、繁殖には影響しなかった。
- Head fat body, peripheral fat tissueに脂質がたまった。
- ほぼ同時に、fat body での過剰発現で寿命が 20 - 50% 延長という論文が別団体からも出ている(6R)。なお、fat body で dPTEN(ショウジョウバエのPTEN)を過剰発現しても長寿になる (14)。
> 脂肪組織での dFoxo 過剰発現は、dlip2 を通じて寿命を延ばすかもしれない (14)。
- Head fat body での dFoxo 過剰発現は、神経細胞 mNSCs で dilp2 の発現を低下させる。
- mNSCs はインスリン様リガンドを分泌する神経で、哺乳類のβ細胞と相同と考えられている。
- しかし、abdominal fat body で過剰発現しても mNSCs dlip2 の発現は変わらない。
広告
References
三浦直行 2004a (Review). 発生・代謝遺伝子として注目を浴びるフォークヘッド遺伝子. 蛋白質核酸酵素 49, 2558-2570.Biggs et al. 1999a . Proc Natl Acad Sci USA 96, 7421-7426.Wang et al. 2009a. BMC Evol Biol 9, 222.Nakae et al. 1999a. Insulin stimulates phosphorylation of the forkhead transcription factor FKHR on serine 253 through a wortmannin-sensitive pathway. J Biol Chem 274, 15982-15985.Nakae et al. 2000a. Differential regulation of gene expression by insulin and IGF-I receptors correlates with phosphorylation of a single amino acid residue in the forkhead transcription factor FKHR. EMBO J 19, 989-996.Giannakou 2004a. Long-lived Drosophila with over-expressed dFOXO in adult fat body. Science 305, 361.Hwangbo 2004a. Drosophila dFOXO controls lifespan and regulated insulin signaling in brain and fat body. Nature 429, 562-567.Matsuzaki et al. 2005a. Acetylation of Foxo1 alters its DNA-binding ability and sensitivity to phosphorylation. Proc Natl Acad Sci USA 102, 11278-11283.Lam et al. 2013a (Review). Forkhead box proteins: tuning forks for transcriptional harmony. Nat Rev Cancer 13, 482-495.Medema et al. 2000a. AFX-like transcription factors mediate cell-cycle regulation by Ras and PKB through p27kip1. Nature 404, 782-787.Accili and Arden 2004a (Review). FoxO as the crossroads of cellular metabolism, differentiation, and transformation. Cell 117, 421-426.Brunet et al. 2004a. Stress-dependent regulation of FOXO transcription factor by the SIRT1 deacetylase. Science 303, 2011-2015.Furuyama et al. 2000a. Identification of the different distribution of mRNAs and consensus binding sequences for mouse DAF-16 homologues. Biochem J 349, 629-634.Broughton and Partridge 2009a (Review). Insulin/IGF-like signaling, the central nervous system and aging. Biochem J 418, 1-12.McCormick et al. 2012a. New genes that extend Caenorhabditis elegans' lifespan in response to reproductive signals. Aging Cell, 11, 192-202.Sun et al. 2012a. Nutrient-dependent requirement for SOD1 in lifespan extension by protein restriction in Drosophila melanogaster. Aging Cell 11, 783-793.Huang et al. 2007a. Dynamic FoxO transcription factors. J Cell Sci, 120, 2479-2487.北村 & 北村, 2015a. 各臓器における FOXO1 の代謝作用. 生化学, 87, 176-182.Spellberg MJ & Marr MT 2nd, 2015a. FOXO regulates RNA interference in Drosophila and protects from RNA virus infection. PNAS, 112, 14587-14592.Zhang et al. 2002a. Phosphorylation of serine 256 suppresses transactivation by FKHR (FOXO1) by multiple mechanisms. Direct and indirect effects on nuclear/cytoplasmic shuttling and DNA binding. J Biol Chem 277, 45276-45284.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
