ヒトのもつE3ユビキチンリガーゼの種類とその特徴
UBC/protein_gene/e/erythropoietin
|
このページは keito0628 様に執筆頂いた依頼記事です。 |
広告
ユビキチンリガーゼ (E3) とは
ユビキチンリガーゼ (E3) は、ユビキチンが結合したE2 (ユビキチン結合酵素) と結合し、タンパク質の基質を認識し、E2から基質へのユビキチンの転移・触媒するタンパク質である。
ユビキチンは基質タンパク質のリジン残基(K)にイソペプチド結合によって付加される。E3リガーゼは基質とE2酵素の両方に相互作用し、それによってE2酵素へ基質特異性が付与される。
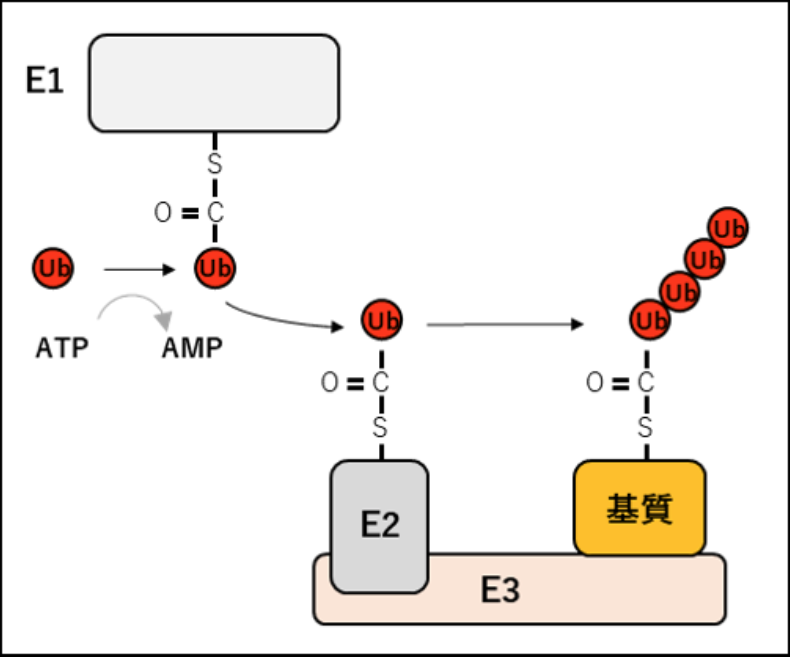
E3リガーゼは、ユビキチンの48番のリジン残基(K)を介して連結されたユビキチン鎖を基質に付加してポリユビキチン化し、プロテアソームによる破壊の標的にすることが有名であるが、他にも多くの種類のユビキチン結合鎖も可能であり、それによってタンパク質の活性、相互作用、または局在が変化する。
E3リガーゼによるユビキチン化は、細胞の移動、DNA修復、シグナル伝達、細胞周期の制御など多様な活動を調節しており、細胞生物学において極めて重要な因子である。
ヒトゲノムには600種類以上のE3リガーゼがコードされていると推定されており、多くの基質多様性があると考えられている。
ヒトの持つE3ユビキチンリガーゼの種類とその特徴
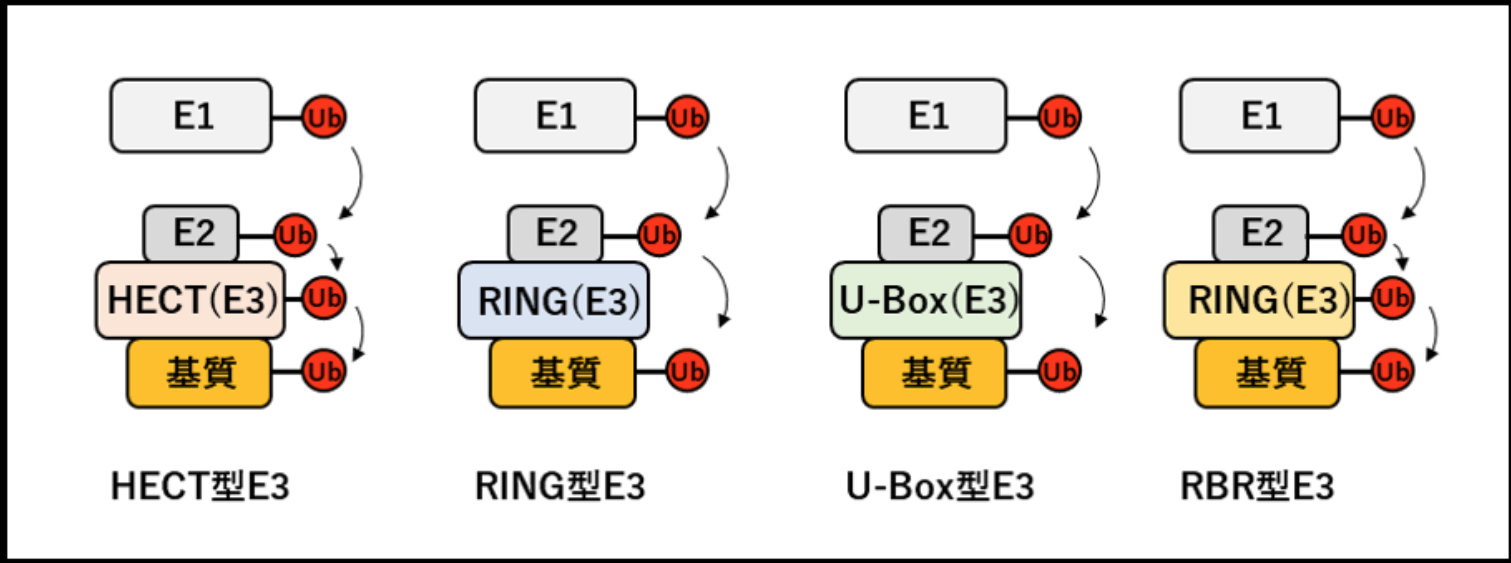
ヒトは約500–1000種類のE3リガーゼを持つと推定されており、それによってE1とE2に基質特異性が付与されている。E3リガーゼは、RING型、HECT型、U-box型、RBR型という4つのファミリーに分類される。
HECT型 |
HECT 型 E3は E2と結合し,HECTドメインの活性中心であるシステイン(Cys)がユビキチンとチオエステル結合を形成し,この中間体を介して基質をユビキチン化する。つまりHECT 型 E3は,E1、E2と同様にユビキチン―チオエステル結合を介して基質にユビキチンを付加する。 |
RING型 |
RING フィンガーモチーフが E2と 結合し、E2-チオエステル中間体からのユビキチンの遊離を促進することで、RING 型 E3が基質と結合して基質をユビキチン化する。つまりRING 型 E3は E2-ユビキチン複合体と 基質の両方に結合し、両者を近くに配置しながら、E2-ユビキチン中間体から基質へのユビキチンの移動を容易にすることで基質をユビキチン化している。 |
U-box型 |
RING ドメインと立体構造が非常に良く 似ているが,RING ドメインの特徴であるシステイン残基による亜鉛イオンの配位ではなく,その他のアミノ酸残基による水素結合によってその構造を維持している。 |
RBR型 |
RBR型E3は、ユビキチンとチオエステル結合したE2がRING1ドメインに結合し、RING2ドメインのシステイン(Cys)にチオエステル結合した中間体を形成し、RBR型E3に結合した基質へ転移する特徴を持つ。 |
References
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
