X結晶構造解析やin vitro アッセイに用いるタンパク質の精製法
experiments/protein/concentration_biuret
このページの最終更新日: 2025/11/23|
このページは keito0628 様に執筆頂いた依頼記事です。 |
広告
大腸菌によるタンパク質の発現
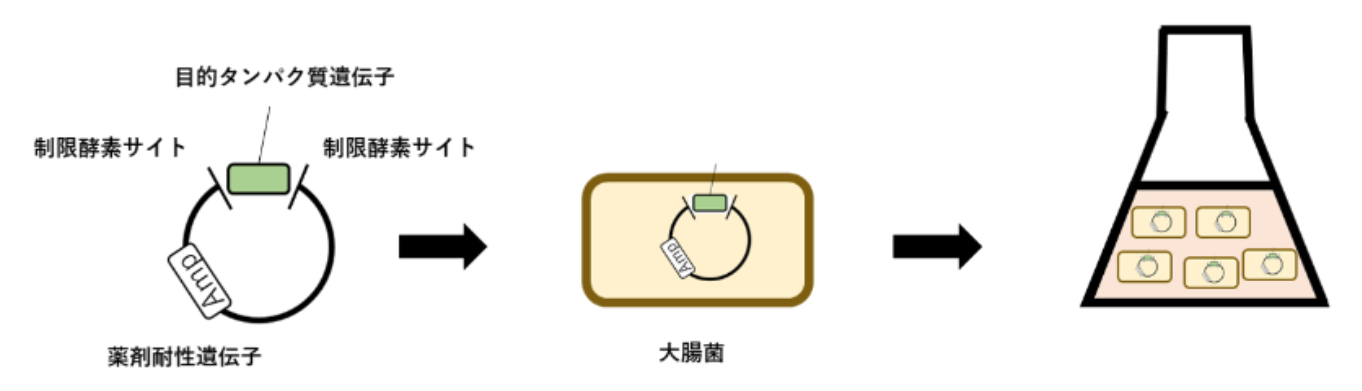
外来遺伝子由来のタンパク質は大腸菌に発現させる。
- 外来遺伝子は制限酵素を利用してplasmidに導入します。このときに、plasmidは薬剤耐性遺伝子を持っているものを使用。Amp(アンピシリン)やKm(カナマイシン)耐性のものを使用するのが一般的である。
- 形質転換によって大腸菌にplasmidを取り込ませる。その後、plasmidの薬剤耐性を利用し、この抗生物質を含む培地で培養すると、形質転換された大腸菌のみが増殖し、目的遺伝子を発現可能な大腸菌のみを選択することができる。
- 大腸菌を培養し、培地が濁るくらいに増やす。
- 発現誘導試薬(一般的にIPTG)を加えると、plasmid中の目的タンパク質が発現する。発現誘導後は、数時間から1日程度培養して目的タンパク質を大量発現させる。
- 遠心操作で、大腸菌のみを回収。
大腸菌細胞破砕 & 遠心分離
- 回収した大腸菌に低浸透圧緩衝液(Lysis buffer)を加えて完全にすべての細胞を氷冷下で数回に分けて超音波処理を行う。十分に溶解するまで繰り返す。
- 操作中は熱を泡が発生しタンパク質の変性を招くため、氷中で冷却しながら短時間で処理する。
- 細胞片や不要物を除去するために30min、30000xg、4℃で遠心し、上清を回収する。
タンパク質の精製
「タンパク質精製」には、目的タンパク質の種類・性質・分子サイズ・含有量などに応じて多種多様な精製方法があり、精製したタンパク質の確認は一般的に電気泳動やアミノ酸配列解析などの技術を用いて行われる。
代表的なものを以下に紹介する。
アフィニティークロマトグラフィー
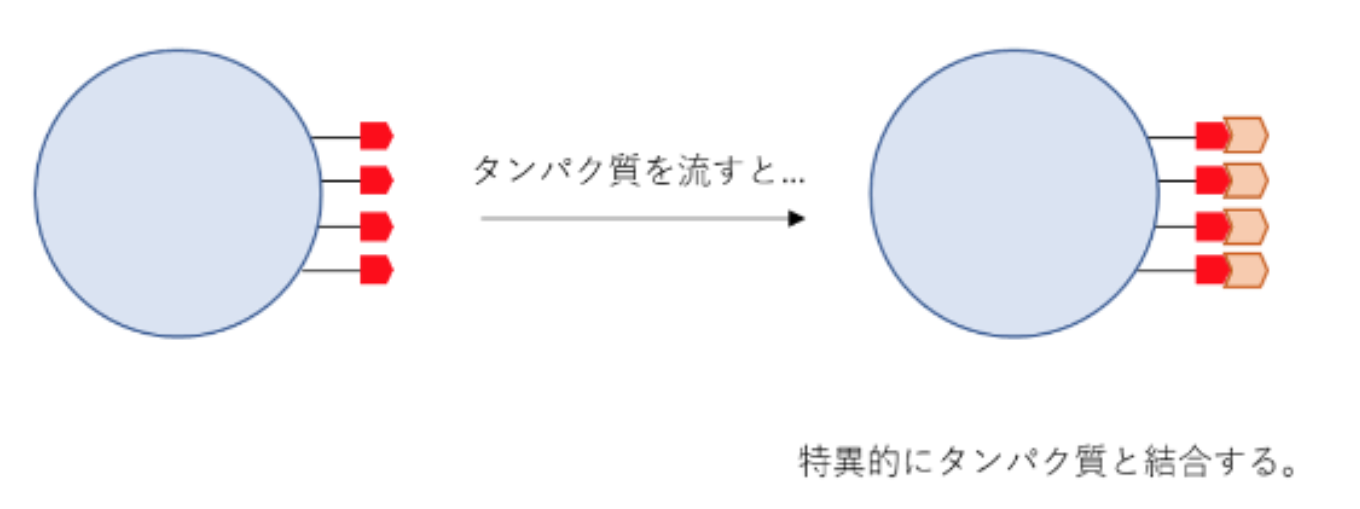
アフィニティークロマトグラフィーは、特定の物質との親和性を利用して分離する手法のこと。目的のタンパク質又はタンパク質に共有結合したタグに直接結合することができる。アフィニティークロマトグラフィーは最も荒っぽい精製方法であり、一般的に精製の初期段階で使用される。精製後の用途によって、アフィニティー精製が適切な純度を達成する場合もある。
イオン交換クロマトグラフィー(IEX)
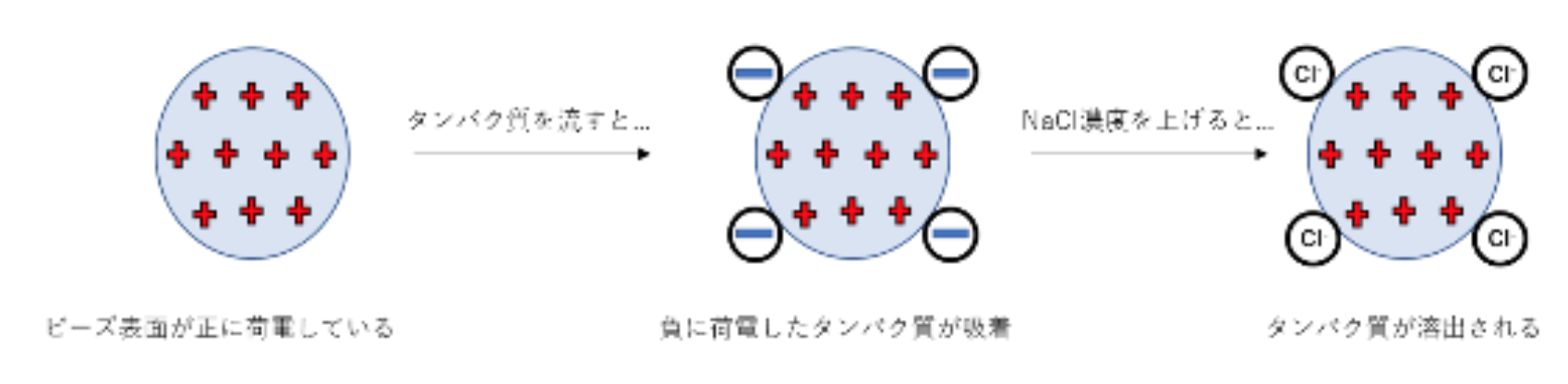
イオン交換クロマトグラフィー(IEX)は、タンパク質固有の等電点の違いによって分離する手法。IEXは陰イオン交換(負に電荷したタンパク質に結合する正に電荷した固定相)と陽イオン交換(正に荷電したタンパク質に結合する負に荷電した固定相)の2種類がある。タンパク質の正味荷電は溶解する溶媒のpHの影響を受け、タンパク質の等電点(pI)よりの上のpHはタンパク質は正味の負電荷を有し、pIより低いpHは正味の正電荷を有する。溶媒のpHは、IEXへの結合するように、または結合タンパク質の溶出を促進するように調節する。
疎水性相互作用クロマトグラフィー(HIC)
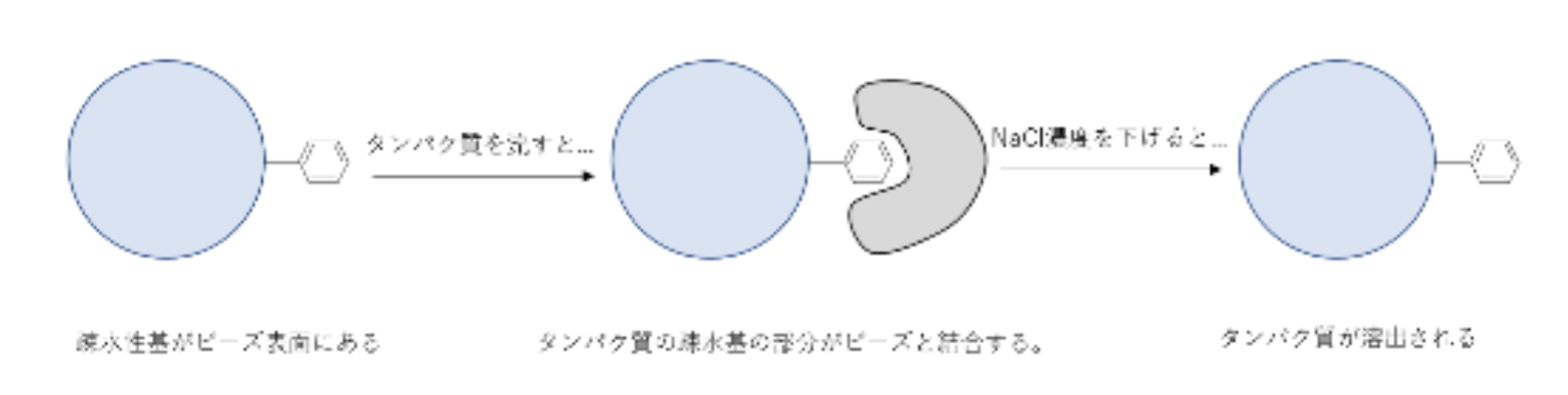
疎水性相互作用クロマトグラフィー(HIC)は、その疎水性に基づてタンパク質を分離する。溶液中の塩イオンの存在は部分タンパク質のアンフォールディングと通常であれば内側に埋もれるはずの疎水性残基の露出につながることもある。低イオン強度を持つ緩衝液が追加されると固定相と結合するタンパク質はもともとの形に戻ろうとする。これにより固定相と相互作用する疎水性残基の減少させ、カラムから溶出する。
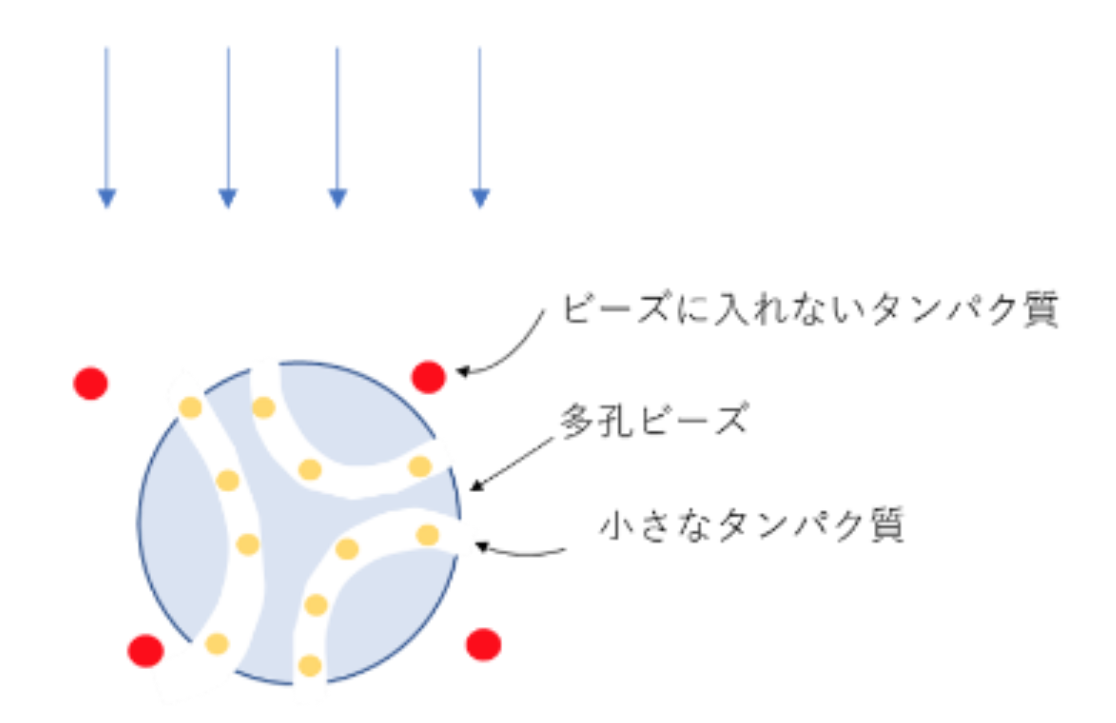
ゲル濾過クロマトグラフィー
ゲルろ過クロマトグラフィー(SEC)は、それらの流体力学的半径、分子の大きさと形状の両方によって決定される特性によってタンパク質を分離する。上記のようなクロマトグラフィー手順と異なり、タンパク質は固定相に結合しない。その代わりにタンパク質は、それらが固定相内を移動する速度によって分離される。ほとんどの場合、精製の最終段階で使用される。
広告
References
- Amazon link: Molecular Cloning: A Laboratory Manual, Fourth Edition
Cold Spring Harbor Laboratory Press.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
