Ub化機構に必要な酵素とそのメカニズム
UBC/protein_gene/u/ubiquitin_enzymes
このページの最終更新日: 2025/11/23- Ub化機構に必要な酵素
- ユビキチン化は多目的なシグナルに使われる
|
このページは keito0628 様に執筆頂いた依頼記事です。 |
広告
ユビキチン-プロテアソーム系 (UPS) とは
ユビキチン化は、免疫応答を含むさまざまな生物学機能の調節において中心的な役割を果たす。ユビキチン化はE1(活性化酵素)、E2(結合酵素)、およびE3(ユビキチンリガーゼ)の3種類の酵素反応の働きにより、E3が選択的に識別する標的タンパク質(基質)にATP依存的にユビキチンを結合させる翻訳後修飾系である。
酵素によりユビキチン鎖の特定の結合タイプが生成または加水分解され、そのユビキチン鎖のさまざまな結合タイプによって基質の運命を制御される。
ユビキチン化はいくつかの酵素反応カスケードによって媒介される一種の翻訳後修飾である2種類のE1ユビキチン化活性酵素、約40種類のE2ユビキチン化結合酵素、700種類の以上のE3リガーゼがある。
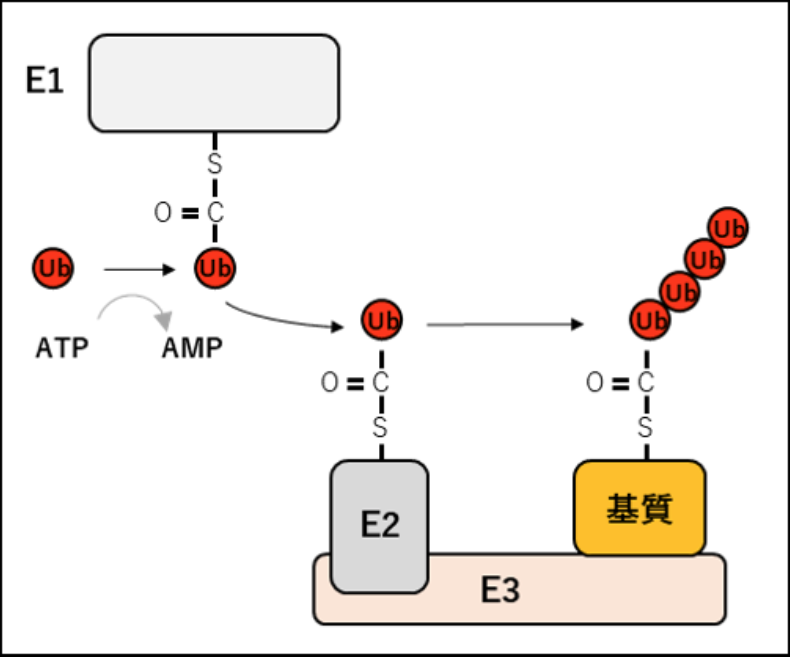
選択的に標的タンパク質(基質)を識別することができるE3はユビキチン修飾系において重要で、E3は基質が存在していれば必ず識別できるのではなく、リン酸化、プロリン水酸化などの翻訳後修飾などの標的タンパク質(基質)側の変化や、E3タンパク質の発現誘導も選択的な基質識別において重要な役割を果たしていることが明らかになっている。
E1、E2、E3酵素は、ヒトのタンパク質をコードする遺伝子の約5%を構成し、細胞プロセスと経路のユビキチンベースの調節の重要性を示している。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
ユビキチン化は多目的なシグナルに使われる
ユビキチンは構造的に安定であり、基質の翻訳後修飾のために使われる76アミノ酸のタンパク質です。基質のユビキチン結合には、ユビキチンのC末端グリシン(Gly)は、一般的に基質のリジン(Lys)に結合する。
ユビキチンは、固有のLys残基(Lys 6、Lys 11、Lys 27、Lys 29、Lys 33、Lys 48、Lys 63)、およびメチオニン(Met)1を使用してユビキチン鎖を形成します。48番目のLys側鎖(K48)を介したポリユビキチン鎖はタンパク質の分解シグナルとなるが、K63を介したポリユビキチン鎖はDNA修復、シグナル伝達に機能するなど、ポリユビキチン鎖の種類によってタンパク質の機能が異なると考えられている。ユビキチンの7個のリジン側鎖の全てを介するポリユビキチン鎖が存在し、現在は多様なユビキチン鎖の役割は以下のように報告されている。
|
モノユビキチン |
トラフィッキング、エンドサイトーシス、遺伝子発現、遺伝子サイレンシング |
|
M1型結合型ポリユビキチン鎖 |
NF-κBの活性化 |
|
K63結合型ポリユビキチン鎖 |
DNA損傷寛容、トラフィッキング、翻訳、キナーゼ活性化、非タンパク質分解 |
|
K48結合型ポリユビキチン鎖 |
タンパク質分解(プロテアソーム) |
|
K29結合型ポリユビキチン鎖 |
タンパク質分解(プロテアソーム?) |
|
K6結合型ポリユビキチン鎖 |
マイトファジー、DNA修復 |
|
K11結合型ポリユビキチン鎖 |
EARD? |
広告
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
