ドーパミン受容体: 各種精神疾患に関係する受容体
UBC/protein_gene/d/dopamine_receptor
このページの最終更新日: 2025/11/23広告
概要: ドーパミン受容体とは
神経伝達物質ドーパミン dopamine の受容体。D1 - D5 の 5 種類が知られており、いずれも heptahelical G-protein coupled receptor (GPCR) である (1,4)。
ドーパミンの作用は、結合する受容体によって異なる。つまり、投射先の領域で受容体が発現しているパターンによって、ドーパミンが分泌された際に神経が活性化される場合と抑制される場合がある。したがって、ドーパミンの生理機能を考える際に、受容体の分布は極めて重要である。
ドーパミン受容体は D1-like と D2-like に分類され、以下の表のように D1 および D5 が D1-like である。残りの 3 種は D2-like とされる。分類は機能によってなされており、Gs/olf を介してアデニル酸シクラーゼを活性化するのが D1-like, Gi/o を介してアデニル酸シクラーゼを阻害するのが D2-like である (4)。
D1- および D2-like receptors は同じ細胞で発現し得るが、大部分のニューロンは片方のみを発現する (1)。 両方を発現している場合でも、発現量には大きな違いがあり、機能しているのは片方のみと予想される。
| D1-like | D1R |
|
| D5R |
|
|
| D2-like | D2R |
ドーパミンが D2R に結合すると、活動電位を 抑制 する (9I)。K+ channel を活性化し、神経細胞の過分極を引き起こすため。したがって D2R antagonist の投与直後には、神経は活性化する。 しかし、21 日間などの長期投与は、むしろドーパミン作動性ニューロンを抑制する。Depolarization block という現象で、神経が hyperexcited な状態になっているためである。 |
| D3R | ||
| D4R |
|
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
ドーパミン受容体下流のシグナル伝達
GPCR は一般に複数の G タンパク質 と相互作用する。ドーパミン受容体も例外でなく、そのため下流のシグナル伝達は非常に複雑である。
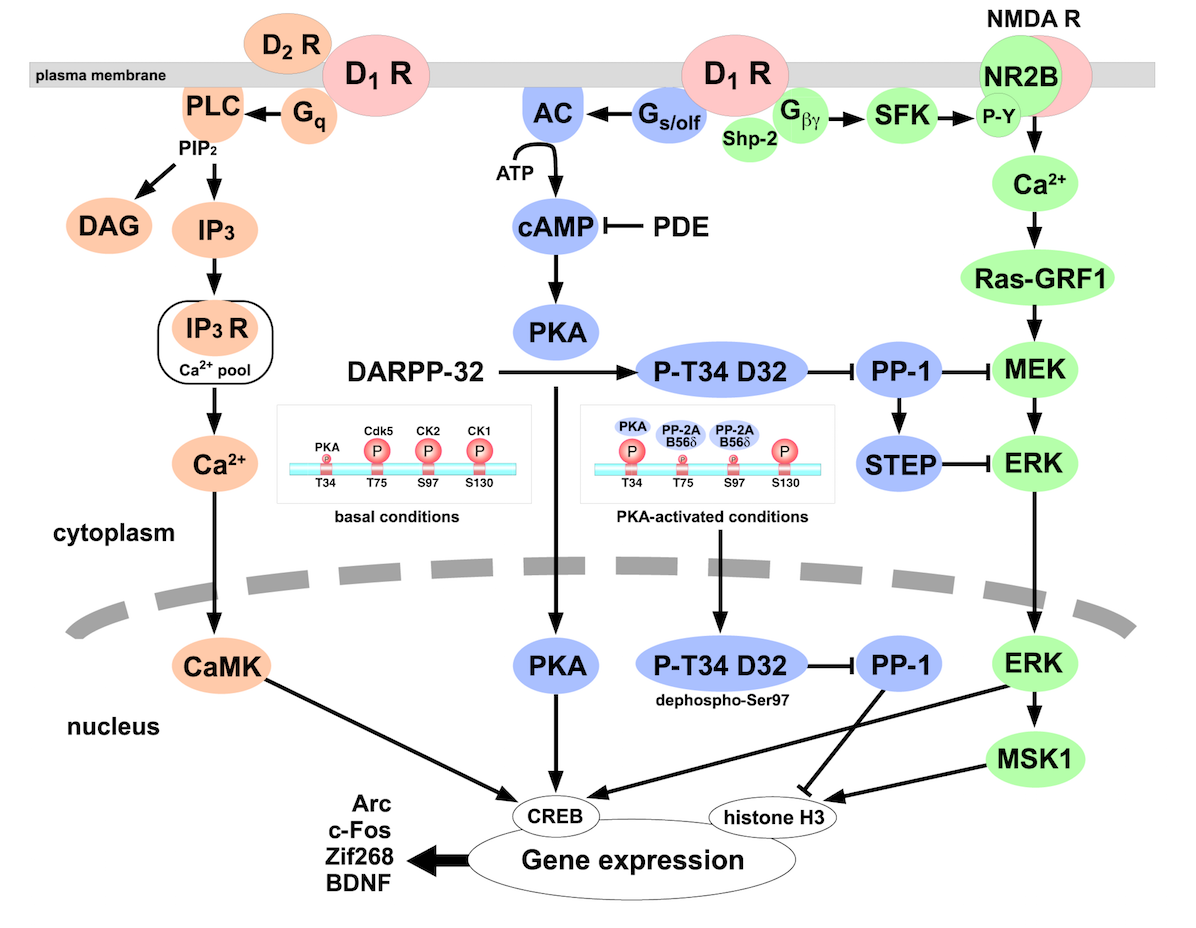
cAMP シグナル
ドーパミンが D1R に結合すると、Gs/olf を介してアデニルシクラーゼ (AC)を活性化する (4)。AC は ATP から cAMP を合成する反応を触媒する酵素である。その後のシグナル伝達は、おそらく細胞の種類によって異なるのだろう。
> 線条体 striatum の D1R 発現細胞では、cAMP/PKA signal が活性化される (4)。
- 上の図も Ref 4 から。DARPP-32 が PKA の主要な標的である。PKA は DARPP-32 Thr34 をリン酸化する。
- リン酸化 DARPP-32 は、プロテインホスファターゼ PP-1 を阻害する。
- PP-1 の下流には、神経伝達物質の受容体のサブユニットが多数存在する。GluR1, NR1 など。
- また、各種イオンチャネルや転写因子もある。
AC の活性化は D1R で有名だが、D4R でも生じる (1)。生じる cAMP は PKA および DARPP-32 を活性化する。さらに下流には NF-κB がある。
ドーパミン受容体は、G タンパク質のほかにも多くのタンパク質と結合する (1)。アデニル酸シクラーゼ、PKC, Grb2, Nck との結合が知られている。
MAPK シグナル
> D2-like receptors は、mitogen-activated protein kinase (MAPK) を通じて減数分裂を制御する (1)。 減数分裂に対する影響は、促進および抑制の両方の報告がある。
カルシウムシグナル
上の図にあるように、D2R はPLC を介してカルシウムシグナルを活性化する (4)。これは DARPP-32 を脱リン酸化する。
D4R は、細胞の種類に応じて多くのメカニズムで細胞内カルシウム濃度を調節する (1)。その下流には Ca2+/calmodulin-dependent kinase (CaMKII) や AMPA receptors がある。
広告
D2R と病気
ドーパミンD2受容体の分布は、アゴニスト[11C] racloprideを使ったPETで調べることができる (10I, 6R)。ラクロプリド raclopride は図のような構造をもつドーパミン拮抗薬で、D2R に結合する。そのため、PET で結合量を測定することで、D2R 量を見積もることが可能である。
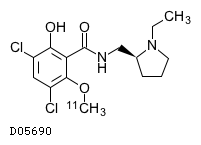
この方法は in vivo での測定が可能であることがメリットであるが、内在のドーパミン量が変化した場合に raclopride の結合量も変わってしまうというデメリットがある。また、raclopride は D2R と D3R の両方に結合する (2D) こともデメリットの一つであり、in vivo 測定の結果は解釈が難しい。そのため、文献6などでは他の拮抗薬を用いた brain slice のオートラジオグラフィーを同時に行い、内在性ドーパミンの影響を除いた結果も得ている。
肥満
線条体の D2R 量は、肥満 obesity では低下、統合失調症 schizophrenia では増大する傾向にあるようである。しかし、いずれの場合もD2R 量の変化が病気の原因であるか結果であるかはわからない。
ヒトでは、D2R の発現量低下に繋がるような多型と、肥満のリスクが相関 (5D)。
- 実際に、肥満したヒトは、痩せたヒトよりも線条体のD2R量が低かった。
- BMIが 40 以上の肥満のヒトは線条体のD2R量が低いという別の報告も。
- これらのヒトでは dorsolateral PFC, medial orbitofrontal cortex, anterior CG のグルコース代謝も低い。
- これらの領域は、過食症との関連も示唆されており、合理的な結果と言える。
- Somatosensory cortex のグルコース代謝も肥満したヒトで低く、これは意外な結果であると述べている。
> 線条体のD2R量が低いヒトほど、ストレスで物を食べる方向に応答する (6)。
- 上の図も Ref 4 から。DARPP-32 が PKA の主要な標的である。PKA は DARPP-32 Thr34 をリン酸化する。
- リン酸化 DARPP-32 は、プロテインホスファターゼ PP-1 を阻害する。
- PP-1 の下流には、神経伝達物質の受容体のサブユニットが多数存在する。GluR1, NR1 など。
- また、各種イオンチャネルや転写因子もある。
> 肥満モデル Zucker rat では、線条体D2Rの量が低い。
- [11C] raclopride を使ったPETの実験 (6R)。
- Striatum の膜画分を抽出し、人工リガンド[1H]YM-09151-2 との結合をみた実験 (3R)。
- Obese prone miceでも、線条体 D2R の量が少ない (8R, 5D)。
広告
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
References
Rondou et al. 2010a (Review). The dopamine D4 receptor: biochemical and signalling properties. Cell Mol Life Sci 67, 1971-1986.Martin et al. 2013a. In vivo imaging of dopaminergic neurotransmission after transient focal ischemia in rats. J Cereb Blood Flow Metab 33, 244-252.Thanos et al. 2008b. Food restriction markedly increases dopamine De receptor (D2R) in a rat model of obesity as assessed with in-vivo µPET imaging ([11C] raclopride) and in-vitro ([3H] spiperone) autoradiography. Synapse 62, 50-61.Nishi et al. 2011a. Mechanisms for the modulation of dopamine D1 receptor signaling in striatal neurons. Front Neutoanat 5, 43.- Volkow et al. 2008a. Low dopamine striatal D2 receptors are associated with prefrontal metabolism in obese subjects: possible contributing factors. NeuroImage 42, 1537-1543.
- Thanos et al. 2008b. Food restriction markedly increases dopamine D2 receptor (D2R) in a rat model of obesity as assessed with in-vivo µPET imaging ([11C] raclopride) and in-vitro ([3H] spiperone) autoradiography. Synapse 62, 50-61.
- Huang et al. 2006a. Dopamine transporter and D2 receptor binding densities in mice prone or resistant to chronic high fat diet-induced obesity. Behav Brain Res 175, 415-419.
- Volkow et al. 2011a (Review). Reward, dopamine and the control of food intake: implications for obesity. Trends Cogn Sci 15, 37-46.
Perez et al. 2012a. Aberrant dopamine D2-like receptor function in a rodent model of schizophrenia. J Pharmacol Exp Ther 343, 288-295.
