組織染色実験の概要
UBC/experiments/
- 組織染色実験の概要
- 組織の固定
- さまざまなタイプの染色
- 免疫染色
- In situ ハイブリダイゼーション
- H & E 染色
- その他の染色
- 染色実験の定量
広告
組織染色実験の概要
固定方法と染色方法の組み合わせからまとめる。
組織の固定
組織の固定方法は、もちろん染色の種類によって異なるが、一般的には次の 3 通りである (1)。
- 未固定凍結: 未固定のまま OCT コンパウンドに包埋して凍結切片を作る。
- 固定凍結: 試薬で組織を固定したのち OCT コンパウンドに包埋し、凍結切片を作る。
- パラフィン: 試薬で組織を固定したのち パラフィン包埋し、切片を作る。
形態の保持はパラフィン切片が優れているが、煩雑であったり脂質染色に使えなかったりと、それぞれ一長一短がある。組織の固定には、以下のような試薬が使われる。大きく分けてアルデヒド系と有機溶剤系がある (1)。
アルデヒド系
- パラホルムアルデヒド Paraformaldehyde, PFA
- グルタルアルデヒド Glutaraldehyde
有機溶剤系
さまざまなタイプの染色
免疫染色
抗体 antibody を用いて、目的とする タンパク質 を染色する方法を 免疫染色 immunostaining という。組織の固定に際して、主に以下の 3 点に留意する (1)。
- 目的タンパク質の抗原性の保持 (抗体に結合できる状態が保たれているかどうか)
- 目的タンパク質の発現部位の保持 (他の場所に移動していないかどうか)
- 組織の形態の保持
組織の固定法によって、以下のような違いがみられる (1)。
- 未固定凍結: 抗原性がよく保持されるが、形態の保持が悪い。
- 固定凍結: 抗原性、形態ともによく保持される。
- パラフィン: 形態保持に優れるが、抗原性の保持が悪い。パラフィン切片に使用可能な抗体を選んで使う。標本は常温で保存が可能である。
アルデヒド系で固定すると、低分子の不溶化や形態保持に優れるが、タンパク質やペプチドの抗原保持に難点がある。
有機溶剤は脱水作用があり、これで固定すると組織が収縮してしまう可能性がある。高分子の抗原保持に優れる。
In situ ハイブリダイゼーション
一般には、DNA または RNA のプローブを用いて、目的とする mRNA を組織において染色する方法である。詳細は in situ ハイブリダイゼーション のページにまとめた。
検出に蛍光を用いる in situ ハイブリダイゼーションは fluorescent in situ hybridization (FISH) と呼ばれる。染色体 を対象に実験を行い、目的とする遺伝子の染色体の位置を特定する方法をとくに FISH と呼ぶことが多い。
H & E 染色
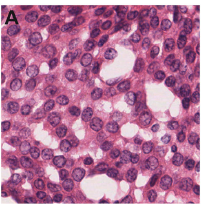
ヘマトキシリン・エオシン染色 (HE 染色) は、基本的な組織染色法の一つで、光学顕微鏡レベルで組織の全体像を把握することを目的とする (2)。
組織切片を顕微鏡で観察すると、基本的にはほぼ無色であり、構造をよく見ることができない。そこで、HE 染色のような「基本的な」染色法が必要になるわけである。
図は 代表的な H & E 染色像、Veta et al. PLoS ONE 8, e70221, 2013 より引用。この染色法の詳細は H & E 染色 のページにまとめた。
その他の染色
いずれ更新するが、とりあえずは 実験方法の目次 の染色実験の項を参照のこと。
染色実験の定量
染色実験の結果を論文にまとめるときには、基本的に次のような写真を出すことになる。
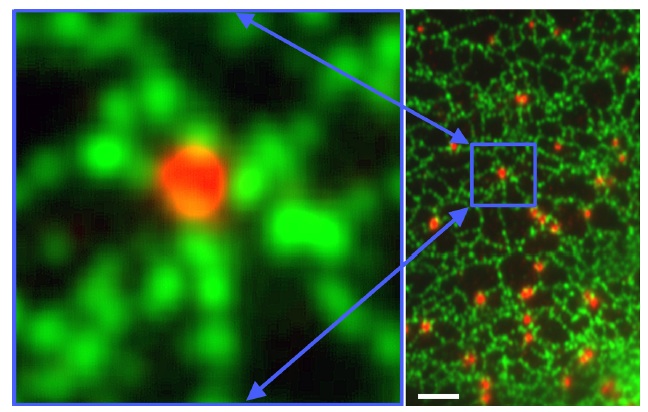
蛍光染色像、Brasaemle et al. J Biol Chem 287, 2273-2279, 2012. |

H&E染色像、Veta et al. PLoS ONE 8, e70221, 2013. |
ただし、このような染色像のデータには、常につきまとう問題がある。それは「その写真が本当に一般的な傾向を反映しているのか」という問題である。つまり、論文では「その写真がたまたま撮れたチャンピオンデータではない」ことを示した方が説得力が出る。
しかし、何百枚も写真を論文に Figure や Supplement として載せるのは現実的ではない。このような場合、写真に写っているデータで「言いたいこと」を定量し、グラフにするという手段がとられる。
この点についてはいずれ詳しく述べたいが、とりあえずの注意点。切片を使って何かを定量するときは、切片同士が十分に離れていることが極めて重要である。隣り合った切片から得られる定量データはほぼ同じなので、重複してカウントしていることになってしまう。
広告
References
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
