アミノ酸の電離と pH
UBC/aa_carbo_lipid/aa/aa_dissociation
このページの最終更新日: 2025/01/05- アミノ酸の電離と pH
広告
アミノ酸の電離と pH
pKa は、アミノ酸の構造や機能に関わる非常に重要な概念である。これを理解すると、たとえば酵素の活性中心になぜヒスチジン His が位置することが多いのかなどが説明できるようになる。
以下のページを順に読むとわかりやすいように書いたつもりなので、参考までに。
アミノ酸の共通部分は、COOH および NH3+ の 2 つの官能基をもっているが、重要なのは
ゆえに、以下のことが言える。
- 生理的 pH (中性, pH = 7 付近) では、カルボキシル基は COO- に、アミノ基は NH3+ になっている。この状態を dipolar form (dipolar ion) という。
- なお、pH < 4.0 ぐらいから COOH を、pH > 8 ぐらいから NH2 を含むアミノ酸が増えてくる (2)。
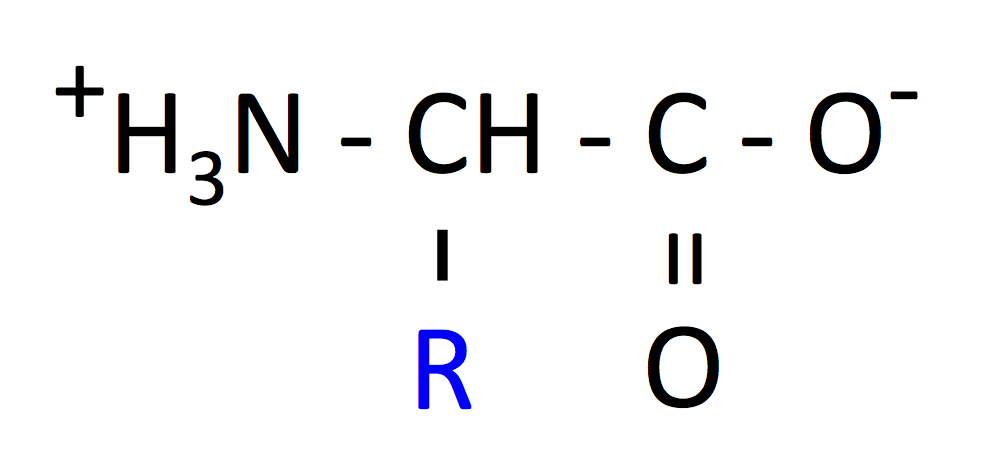
広告
References
IUPAC-IUB Joint Commission on Biochemical Nomenclature, 1984a. Nomenclature and Symbolism for Amino Acids and Peptides. Eur. J. Biochem. 138. 9-37. Link: Last access 2018/07/25.
コメント欄のアップデート前、このページには以下のようなコメントを頂いていました。ありがとうございました。
|
2018/02/21 07:03 試験前にチェック! 素晴らしいです。。。 |
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
