グリコーゲンホスホリラーゼ:
グリコーゲン分解に関わる第一の酵素
protein_gene/g/glycogen_phosphorylase
10-22-2017 updated
- 概要: グリコーゲンホスホリラーゼとは
- アイソフォーム
- 活性の制御
- 4 つの状態がある
- リン酸化制御
広告
概要: グリコーゲンホスホリラーゼとは
グリコーゲンホスホリラーゼ glycogen phosphorylase とは、グリコーゲン 分解反応を触媒する酵素である (1)。グリコーゲンはグルコースの脱水縮合によって生じるが、以下の理由から加水分解ではなく、リン酸基の付加によって分解される (図、文献 3)。

G1P は非還元末端 (Carbon 4 の OH 基が残っている側) から遊離する。
- 解糖系に入る際に、ATP を消費しなくてすむ。
- グリコシド結合を加水分解すればグルコースが得られるが、解糖するには ATP でリン酸化しないといけない。
- エネルギー準位の近いグリコシド結合とリン酸エステル結合を使えば、ATP のかわりに Pi でリン酸化可能。
- 細胞内に豊富にある Pi を有効利用しているとも言える。
- さらに、筋肉の場合、グルコースが遊離するとトランスポーターを通って細胞外に出てしまう。
- G1P ならトランスポーターがないので、自分で分解に回せる。
この反応を達成するためには、活性部位に水を排除しつつ Pi を引き込まねばならない (2)。これを可能にするメカニズムが構造解析で詳細に調べられている。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
アイソフォーム
グリコーゲンの分解が起こる主な組織は、筋肉と肝臓である (1)。これらの組織では、グリコーゲン分解の目的が異なっている。すなわち、
- 筋肉 → 自分でグルコースをエネルギーとして使う。
- 肝臓 → 他の組織、とくにグルコースに依存する脳 brain や赤血球のために血液中にグルコースを放出する。「血糖値を保つ」と言っても良い。
Glycogen phosphorylase による反応は、グリコーゲン分解の
活性の制御
Glycogen phosphorylase は
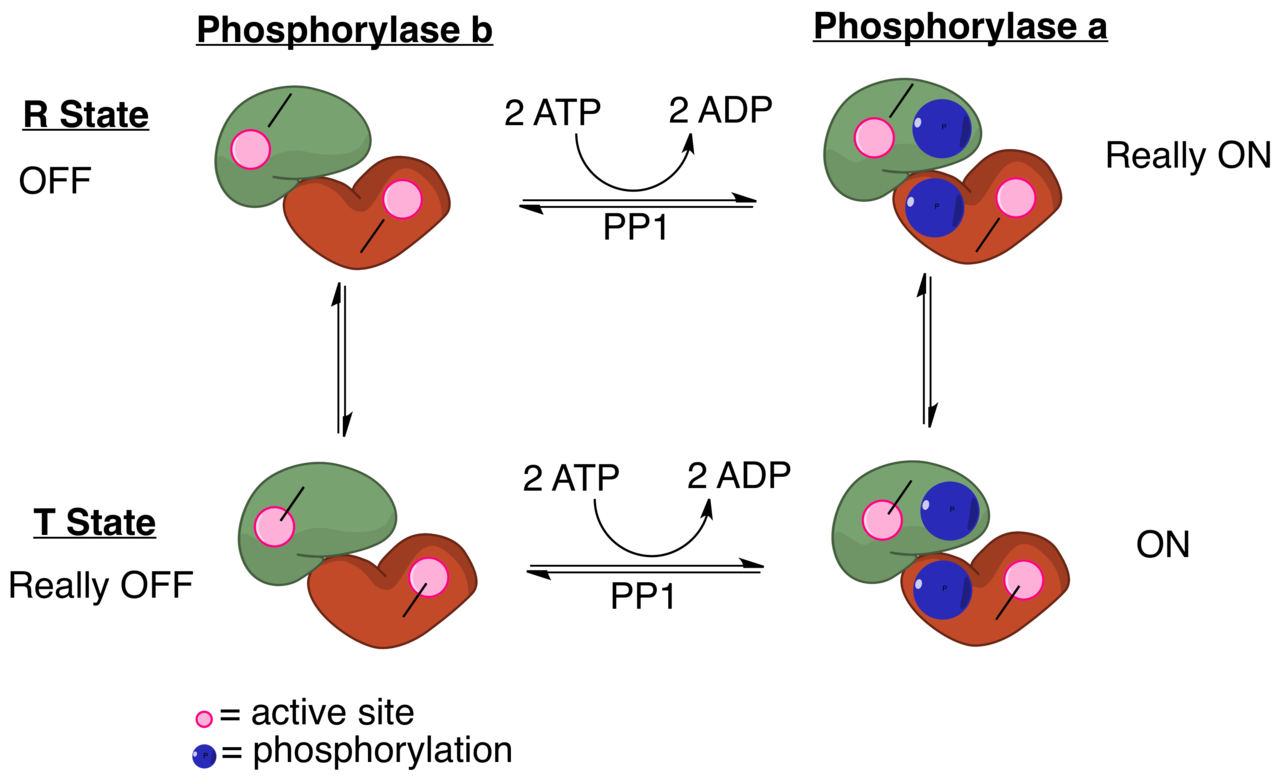
4 つの状態がある
Glycogen phosphorylase はセリン Ser 残基でリン酸化される (1)。脱リン酸化状態を phosphorylase b, リン酸化状態を phosphorylase a と呼ぶ。
a, b はそれぞれ R (relaxed) および T (tense) state という高次構造をとる。
: ATP は AMP と競合し、phosphorylase を不活性化させる方向に働く。
: Glycogen の分解産物 glucose-6-phosphate は、T state の方向にアロステリック阻害する。
→ これは feedback inhibition である。
: つまり glucose は T state の方向に phosphorylase a を アロステリック阻害する。
リン酸化の制御
エピネフリンは筋肉および肝臓の両方で glycogen phosphorylase をリン酸化し、グリコーゲン分解を促進する (1)。以下の 2 つの経路が知られている。
- Epinephreine - β adrenergic receptor - G protein - Adenylate cyclase - cAMP - PKA - phosphorylase kinase - glycogen phosphorylase のリン酸化
- Epinephreine - α adrenergic receptor - phosphoinositide cascade - 細胞内 Ca2+ 濃度が上昇 - phosphorylase kinase - glycogen phosphorylase のリン酸化
: エピネフリンによるグリコーゲン分解の促進は、筋肉 > 肝臓 である。
: 肝臓ではグルカゴン glucagon の作用が大きい。
広告
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
References
- Amazon link: ストライヤー生化学
: 使っているのは英語の 6 版ですが、日本語の 7 版を紹介しています。参考書のページ にレビューがあります。
- By Biochemnerd1 - Own work, CC BY 3.0 us, https://commons.wikimedia.org/w/index.php?curid=15226222
- By Jmun7616 (Own work) [Public domain], via Wikimedia Commons
