老化の酸化ストレス説 (フリーラジカル説)
UBC/aging_lifespan/theory_oxidative
このページの最終更新日: 2025/11/23広告
概要: 老化の酸化ストレス説とは
Harman が1956年に提唱した The free radical theory of aging (老化のフリーラジカル説) が原点とされる (3)。
酸化ストレスの原因となる 活性酸素種 (reactive oxygen species; ROS) には 過酸化水素 (hydrogen peroxide, H2O2) や一重項酸素 (singlet oxygen, 1O2) などラジカルでないものも含まれるため、この説は The oxidative theory of aging (老化の酸化ストレス説) と呼ばれることが多い。
「活性酸素が老化の要因である」とするこの説は広く受け入れられているが、状況はそれほど単純ではない。私が理解しているポイントを簡単にまとめると、以下のようになる。
- 酸化ダメージが老化の原因となるのは正しい。
- しかし、抗酸化が直ちに長寿に結びつくわけではない。
- 酸化ダメージは、老化に関係する遺伝子を動かすためのシグナルとして働いている可能性がある。
図は文献 13 から。
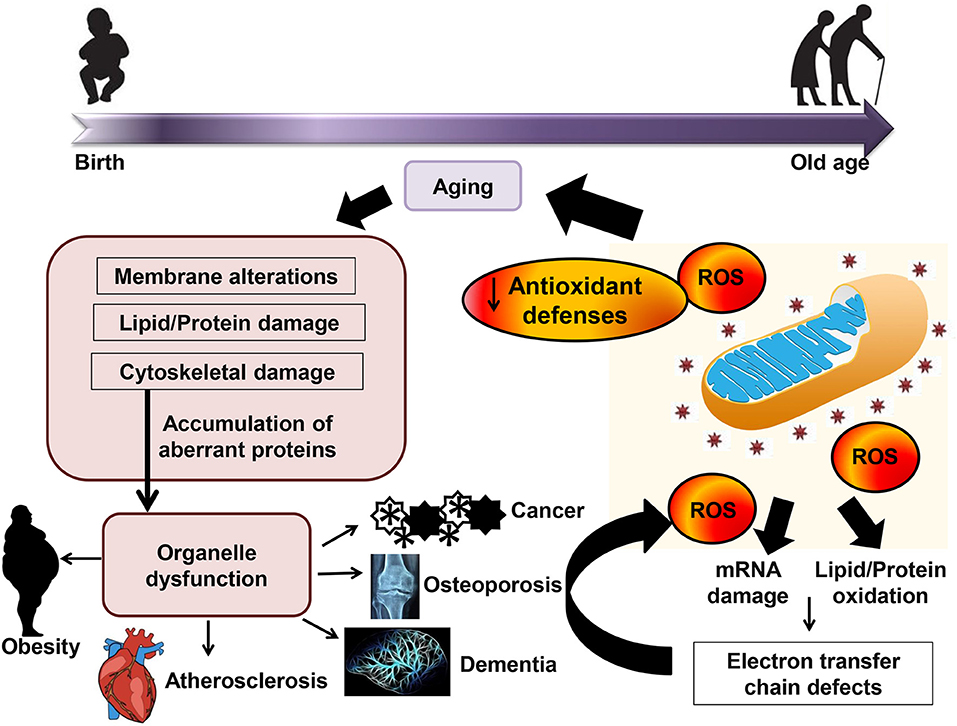
酸化ストレス説を支持する報告
酸素濃度が上がると、寿命は短くなる
> C. elegans の寿命は、酸素濃度を上げると短くなる (1)。
- ただし、その変化は鈍感で、2 - 40% で寿命は変わらない。1% で長寿、60% で短くなる
加齢で酸化ダメージが蓄積する
一般に、老化に伴って生体物質の酸化は進行する。たとえば、タンパク質への酸化ダメージはカルボニル基の生成量によって評価することができる(9)。ただし、その量は組織ごとに異なっており、体全体で比較してもあまり意味がない。
Fisher 344 rat の肝臓、腎臓、腸で、DNA の酸化ダメージの指標 Oh8dG が加齢とともに増加する(5)。
ROS の量と寿命が負の相関
30-40% のカロリー制限を与えたマウスでは、後脚骨格筋ミトコンドリアの酸化ダメージが減る(8)。
Little brown bat は、同程度の代謝速度をもつ哺乳類よりも ROS 産生量が少なく、かつ長寿である(11R)。
鳥類は、同程度の代謝速度をもつ哺乳類よりも ROS 産生量が少なく、かつ長寿である(11I)。
長寿系統の Drosophila では、加齢に伴う ROS 量の増大が穏やかである(11I)。
大腸菌 を過酸化水素で処理すると、DNA に変異が入り死亡する(12I)。
酸化ストレス耐性と寿命が相関する
C. elegans 長寿変異体 age-1 は過酸化水素耐性が加齢とともに上がるが、野生型では変化しない (4)。つまり老齢期での酸化ストレス耐性が寿命と相関している。SOD およびカタラーゼ活性も野生型より高い (4)。
IGFIR のノックアウトマウスは長寿で、酸化ストレス耐性も高い (6)。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
酸化ストレス説を支持しない報告
「支持しない」というよりは、酸化ストレスと老化の関係が単純でないことを示す報告が多い。高酸化酵素を過剰発現する実験、抗酸化物質を投与する実験などは、寿命を延ばさないケースが多いように思う。
抗酸化酵素の阻害実験
- C. elegans は 5 つの sod 遺伝子をもっており、どれかの発現が上がって補償している可能性もある。
酸化ストレス耐性と寿命が相関しない
Drosophilaでは、タンパク質制限で寿命が延びたときにも酸化ストレス耐性は上がらない(10)。
広告References
Gems and Doonan 2009a (Review). Antioxidant defense and aging in C. elegans. Is the oxidative damage theory of aging wrong? Cell Cycle 8, 1681-1687.Orr et al. 2003a. Effects of overexpression of copper-zinc and manganese superoxide dismutases, catalase, and thioredoxin reductase genes on longevity in Drosophila melanogaster. J Biol Chem 278, 26418-26422.Harman 1956a. Aging: a theory based on free radical and radiation chemistry. J Gerontol 3, 298-300.Larsen 1993a. Aging and resistance to oxidative damage in Caenorhabditis elegans. PNAS 90, 8905-8909.Fraga et al. 1990a. Oxidative damage to DNA during aging: 8-Hydroxy-2'-deoxyguanosine in rat organ DNA and urine. PNAS 87, 4533-4537.Holzenberger et al. 2003a. IGF-1 receptor regulates lifespan and resistance to oxidative stress in mice. Nature 421, 182-187.Yang et al. 2007a. A Measurable increase in oxidative damage due to reduction in superoxide detoxification fails to shorten the life span of long-lived mitochondrial mutants of Caenorhabditis elegans. Genetics 177, 2063-2074.Lass et al. 1998a. Caloric restriction prevents age-associated accrual of oxidative damage to mouse skeletal muscle mitochondria. Free Radic Biol Med 25, 1089-1097.Merry 2000aR. Calorie restriction and age-related oxidative stress. Ann N Y Acad Sci 908, 180-198.Sun et al. 2012a. Nutrient-dependent requirement for SOD1 in lifespan extension by protein restriction in Drosophila melanogaster. Aging Cell 11, 783-793.Brunet-Rossini 2004a. Reduced free-radical production and extreme longevity in the little brown bat (Myotis lucifugus) versus two non-flying mammals. Mech Ageing Dev 125, 11-20.Boatright 2013a. Hydrogen peroxide generation from hydrated protein drink mixes. J Food Sci 78, C1651-1658.Tan et al., 2018a (Review). Antioxidant and oxidative stress: a mutual interplay in age-related diseases. Front Pharmacol 9, 1162.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
