抑制性の神経伝達物質 GABA: 構造、機能、代謝など
UBC/other_metabolites/others/gaba
このページの最終更新日: 2025/11/23- 概要: GABA とは
- GABA の生合成
- グルタミン酸からの生合成 (GABA shunt)
- 原料がどこから来るか
- GABA の分解
- GABA と病気
- GABA による神経伝達に影響する要因
広告
概要: GABA とは
GABA (γ-アミノ酪酸、gamma-aminobutyric acid) は、脂肪酸 の一種である酪酸 CH3-CH2-CH2-COOH の γ 炭素にアミノ基 -NH2 がついた物質である。図のような構造をもつ (19)。
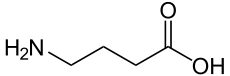
GABA は代表的な
GABA はシナプス後膜の GABA 受容体に結合し、Cl- チャネルを開く作用をもつ。これによって細胞外からCl- が流入し、細胞内の電位がさらに低下する。これを過分極という。これによって興奮が伝わりにくくなる。
GABA の生合成
グルタミン酸からの生合成
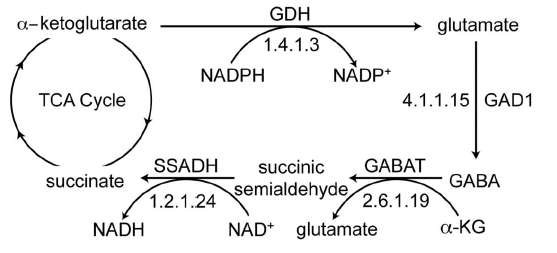
GABA の生合成および分解を総合的にみると、以下のように TCA 回路のバイパス経路 として考えることができる。この経路は
- TCA 回路 の中間体 α-ケトグルタル酸から酵素 GAD によってグルタミン酸 glutamate が合成される。
- グルタミン酸は、グルタミン酸-グルタミンサイクルで使われるが、一部は GABA に変換される。
- GABA は、GABAT および SSADH によって分解され、最終的にコハク酸として TCA 回路に戻る。
GABA の生合成は主に GABAergic neuron で行われるが、分解は GABAergic neuron と astrocyte の両方で行われる (1)。GABAergic neuron では GABA shunt の活性が高く、α-KG のおよそ半分がこちらに流れている (8D)。
グルタミン酸デカルボキシラーゼ glutamate decarboxilase による反応を詳しく見ると、以下の図のようになる。NH2 がついている側の CO2が取り去られる。

グルタミン酸の炭素番号は右から1, 2, 3, 4, 5である。NH2がついているのがC2と覚える。GABAの炭素番号は逆向きになるので、Glu C4 は GABA C2 に対応することになる。
炭素は COOH に結合しているものから順に α、β、γ である。炭素番号は赤の数字で示されている。
原料がどこから来るか
GABA 合成の直接の原料は GABAergic neuron のグルタミン酸であるが、これがどこから供給されるかという問題 がある。そもそもGABAergic neuron では Glu の量が少ない (9I)。さらに、合成酵素 GAD の Km が 0.2 - 1.2 mM であることを考えると、酵素は飽和しておらず、GABAergic neuron 内では Glu の供給が律速であると考えられる。
可能性として以下の3経路が考えられ、様々な結果から 3 が支持されている。
- GABAergic neuron が自前で α-KG から合成したグルタミン酸。
- Glutamatergic neuron がシナプス間隙に放出したGluを、GABAergic neuron が取り込んだもの。
- Astrocyte がシナプス間隙に放出したグルタミン Gln を、GABAergic neuron が取り込んだもの。
GABA はプトレシン putrescine などのポリアミンからも合成されるが、adult rat cortexでは全体の 1% 程度というデータがある (9D)。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
GABA の分解
GABAergic neuron からシナプスに放出された GABA は、GABAergic neuron に再び取り込まれるか、もしくは GABA transporter (GAT) を介して astrocyte に取り込まれる (1)。GABA の分解は、GABAergic neuronまたは astrocyte で以下のように進む。
- GABA-T (GABA transaminase) によりコハク酸セミアルデヒド (SSA, succinic semialdehyde) になる (3)。
- SSA は SSA デヒドロゲナーゼによってコハク酸 succinic acid に変換され、TCA 回路に入る (3)。
- Astrocyteでは、そのままTCA回路を回ってα-KGになり、再びGlu合成に利用されるものもある (9D)。
> GABA-T 阻害薬 vigabatrin で、GABA 量は 2 - 3 倍に増える (5)
- 投与前の濃度は、約 2.5 μmol/g である。
- しかし、そのことによるGABA合成速度の低下はみられない。
- Vigabatrin は astrocyte のGABA-Tを効率的に阻害する。
- GABA-T の活性を gabaculine で完全に阻害すると、合成にも影響するという報告もある。
SSADH-null mouse では、GABA やその代謝産物 γ-hydroxybutyrate が蓄積し、Glu 代謝が低下する (8I, 8R)。
広告
GABA と病気
てんかん
> てんかん患者では、CSF や大脳皮質中の GABA 量が少ない (4I)。
- CSF中では、大部分のGABAはフリーでなくホモカルノシンや2-pyrrolidinone (PRDN) として存在する。
- ヒト occipital lobe でのPRDN濃度は、in vivo測定で0.2 - 0.3 µmol/g である。
ハンチントン舞踏病
脳の特定の領域で GABA 量が低下する (13I)。
統合失調症
統合失調症 schizophrenia では、GABA の量が大脳皮質 cortex や海馬 hippocampus で低下するのが一般的である。
GABA が低下している脳領域では、グルタミン作動性ニューロン等の活性が上昇する。そのため、脳のネットワークがうまく機能しなくなり、認知能力の低下や幻覚などの症状を引き起こすものと考えられている。
統合失調症における GABA 系の異常は、parvalbumin を発現する GABA 作動性介在ニューロン (PV-positive GABAergic interneuron) でみられることが多い (21I) 。このニューロンは、fast-spiking interneuron とも呼ばれる。
このニューロンは、グルタミン酸作動性ニューロンの細胞体 cell body または軸索起始部 axon initial segment に向いており、この神経の活動を強く制御している (21I) 。
> 海馬の脳波は認知能力に重要であるが、これは GABAergic neuron に依存する (20I) 。
- 海馬の gamma oscillations (20-80Hz) は、PV-positive GABAergic interneuron で作られる。
- 海馬に多く発現する α5GABAA 受容体は、シナプス以外の部分に局在しており、γ波の発生を制御。
- α5GABAA 受容体を阻害すると、統合失調症に似た症状が現れる。
> 死後のヒトで調べたところ、大脳皮質全体にわたって GAD-1 mRNA, GAD-67 protein 量が低下 (21I) 。
> 死後のヒトでの PV in situ hybridization では、PV mRNA は layer 3-4 を中心に局在 (22) 。
- 統合失調症では、分布が保たれたまま mRNA 量が50%程度低下している。
- 他の種類の介在ニューロン interneuron で発現するカルレチニン mRNA 量には変化なし。
- PV-positive interneuron における GAD67 mRNA 量も低下していた。
うつ病 depression、アルコール中毒患者などでも脳内のGABA量に異常がみられる (3) 。
GABAによる神経伝達に影響する要因
- ベンゾジアゼピンは、GABA 受容体に結合して中枢神経の活動を抑制する薬品である (10) 。抗不安薬、睡眠薬として用いられている。
- エタノールもGABA受容体と結合し、中枢神経を抑制する作用をもたらす (10) 。ベンゾジアゼピンとは結合部位が異なる。併用は効果が増強されるので望ましくない。エタノールは、同時にエンドルフィンやセロトニンの分泌も促進する。
- グルタミン酸から GABA を合成する GAD は、ビタミンB6を補酵素とする (10) 。ビタミンB6が不足すると、中枢神経の興奮が収まらずにけいれんが生じることがある。
- 爬虫類 (カメ) や魚類では、低酸素または無酸素 anoxia 状態で脳内の GABA が増える (15I, 15R) 。グルタミン酸などの興奮性神経伝達物質は減り、脳のエネルギー消費が低下する。
広告
References
Behar 2004a (Book). Ed. Shulman and Rothman. "Brain Energetics & Neuronal Activity". Chapter 6.Beaulieu 1993a. Numerical data on neocortical neurons in adult rat, with special reference to the GABA population. Brain Res, 609, 284-292.de Graaf et al. 2003a (Review). In vivo 1H-[13C]-NMR spectrometry of cerebral metabolism. NMR Biomed 16, 339-357.Hyder et al. 1999a. Localized 1H NMR measurements of 2-pyrrolidinone in human brain in vivo. Magn Reon Med 41, 889-896.de Graaf et al. 2006a. Acute regulation of steady-state GABA levels following GABA-transaminase inhibition in rat cerebral cotex. Neurochem Int 48, 508-514.Defelipe 2011a (Review). The evolution of the brain, the human nature of cortical circuits, and intellectual creativity. Front Neuroanat 5, 29.Ippolito et al. 2006a. Linkage between cellular communications, energy utilization, and proliferation in metastatic neuroendocrine cancers. PNAS 103, 12505-12510.Chowdhury et al. 2007a. Altered cerebral glucose and acetate metabolism in succinic semialdehyde dehydrogenase-deficient mice: evidence for glial dysfunction and reduced glutamate/glutamine cycling. J Neurochem 103, 2077-2091.Patel et al. 2001a. Glutamine is the major precursor for GABA synthesis in rat neocortex in vivo following acute GABA-transaminase inhibition. Brain Res 919, 207-220.河合良訓 監修 2005a. 脳単. 株式会社エヌ・ティー・エス.Perry et al. 1981a. Postmortem changes in amino compounds for the liberation of GABA in human and rat brain. J Neurochem 36, 406-412.Govindaraju et al. 2000a. Proton NMR chemicha shifts and coupling constants for brain metabolites. NMR Biomed 13, 129-153.Perry et al. 1981a. Postmortem changes of amino compounds in human and rat brain. J Neurochem 36, 406-412.Yang et al. 2005a. In vivo detection of cortical GABA turnover from intravenously infused [1-13C]D-glucose. Magn Reson Med 53, 1258-1267.Lardon et al. 2005a. 1H-NMR study of the metabolome of an exceptionally anoxia tolerant vertebrate, the crucian carp (Carassius carassius). Metabolomics 9, 311-323.Gill et al. 2011a. A novel α5GABAAR-positive allosteric modulator reverses hyperactivation of the dopamine system in the MAM model of schizophrenia. Neuropsychopharmacology 36, 1903-1911.Lodge et al. 2009a. A loss of parvalbumin-containing interneurons is associated with diminished oscillatory activity in an animal model of schizophrenia. J Neurosci 29, 2344-2354.Celio 1986a. Parvalbumin in most gamma-aminobutyric acid-containing neurons of the rat cerebral cortex. Science 231, 995-997.- By NEUROtiker - 投稿者自身による作品, パブリック・ドメイン, Link
Gill et al. 2011a. A novel α5GABA A R-positive allosteric modulator reverses hyperactivation of the dopamine system in the MAM model of schizophrenia. Neuropsychopharmacology 36, 1903-1911.Lodge et al. 2009a. A loss of parvalbumin-containing interneurons is associated with diminished oscillatory activity in an animal model of schizophrenia. J Neurosci 29, 2344-2354.橋本ら 2010a (Review ). 統合失調症と大脳皮質GABA神経伝達異常. 精神神経学雑誌 112, 439-452.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
