質量作用の法則と平衡定数
UBC/other_topics/biochem_basic/law_of_mass_action
このページの最終更新日: 2025/11/23- 概要: 質量作用の法則とは
- 平衡とは
- 質量作用の法則と平衡定数
- さまざまな平衡定数とその性質
- 圧平衡定数
- 濃度平衡定数
- 平衡定数の単位
以下の一連のページが、化学平衡・酸・塩基についてのまとめになっています。体系的に学びたい人は、以下の順に読むことをお勧めします。
- 質量作用の法則と平衡定数 (このページ)
- ルシャトリエの原理
- 酸・塩基の定義
- 水のイオン積と pH
- 解離定数
- 緩衝液 buffer について
広告
概要: 質量作用の法則とは
平衡とは
以下に示すような化学反応は、通常どちらの方向にも進むことができる
aA + bB + ... ⇌ cC + dD + ...
この反応が可逆反応であることは、中央の矢印が両方向であることで表される。
十分に時間が経つと、右向きの反応と左向きの反応の速度が等しくなり、見かけ上変化しない状態に到達する。この状態を
- 水 に過剰量の塩を入れる (4)。塩は溶けきらず、反応は止まっているように見えるが、実際には「塩が溶ける速度 = 析出する速度」という平衡状態である。
- アンモニア を合成するハーバー・ボッシュ法は、平衡状態の説明でよく使われる反応である。
- 生体内で 酵素 に触媒される反応は、基本的に可逆反応であるため平衡状態にある。
以下、このページは高校の化学または大学の生化学で必要な範囲で平衡定数について解説する。大学の化学なら、もう少し上のレベルが必要になる。
質量作用の法則と平衡定数
化学反応 aA + bB + ... ⇌ cC + dD + ... が平衡に達したとき、各成分の濃度の比 K
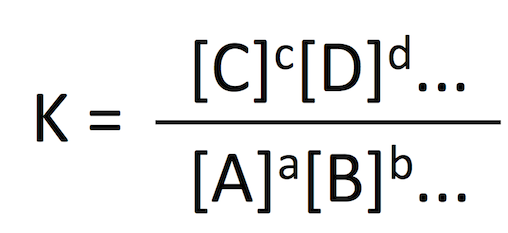
は
- 「K が温度と圧力のみの関数になること」を
質量作用の法則 law of mass action という (1)。 - K は
平衡定数 equilibrium constant と呼ばれる。
平衡定数は温度と圧力のみの関数であるから、定温・定圧では一定の値をとる。感覚的に納得いかないかもしれないが、
この点は極めて重要なので、以下で複数の平衡定数を解説しながら例を挙げていく。
なお、この日本語訳は誤訳であり、mass は「大量」という意味で「質量」の意味ではないらしい。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
さまざまな平衡定数とその性質
圧平衡定数
考える可逆反応が気体の場合、平衡定数は
文献 4 の例を参考に、圧平衡定数が一定温度では変わらないこと、つまり質量作用の法則が成り立つことを示す。
ともに常温で気体である 水素 H2 と 窒素 N2 を混ぜると、以下のようにアンモニアが生成する。
N2 + 3 H2 ⇌ 2 NH3 + 92 kJ
これは 92 kJ の熱を発生させる発熱反応であり、有名な反応である。ここでのポイントは、
この反応の KP は、温度が変わらない限り一定。 N2、H2 などを加えても KP は一定。
- N2 などを加えると、平衡が移動して KP が一定に保たれる。
- あまり好きな説明ではないが、逆に 「KP を一定に保つために平衡が移動する」という考え方もある。
- 詳細は ルシャトリエの原理 のページで解説する。
濃度平衡定数、解離定数
質量作用の法則は、溶液中の化学平衡に対してもよく用いられる。この場合、K は
化学反応が可逆的な分解、すなわち解離 dissociation の場合には、K は解離定数 dissociation constant と呼ばれる。
平衡定数の単位
平衡定数は、本来は熱力学分野で提唱された値で、濃度ではなく活量、圧力ではなくフガシティという値を使って記述される無次元の数であるらしい (2)。
しかし、これらは低濃度あるいは低圧力下では mol/L, atm と一致するように定義されている。したがって、濃度や圧力を近似値として用いることができ、この場合単位が残ることになる。
実際に、酸・塩基の定義と pH のページでは イラストレイテッド ハーパー・生化学 30版 (Amazon) に沿って水の解離の平衡定数 (解離定数) を導いているが、この教科書にはしっかりと mol/L という単位が記載されている。
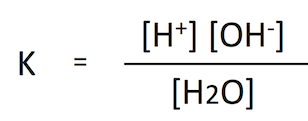
広告
References
- Amazon link: 岩波 理化学辞典 第5版
: 使っているのは 4 版ですが 5 版を紹介しています。
- 平衡定数の単位について. Link.
- Amazon link: 平尾, 加藤 1988a. 化学の基礎 分子論的アプローチ
.
- 哲猫. 化学平衡. 高2理系化学夏期講習テキスト 2009. Pdf file: Last access 2018/01/24.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
