アミロイド β: アルツハイマー患者の脳に蓄積するペプチド
protein_gene/a/amyloid_b
4-3-2017 updated
- 概要: 前駆体 APP の機能
- APP からアミロイド β が生じる機構
- アミロイド β とアルツハイマー病
広告
概要: 前駆体 APP の機能
アルツハイマー病 の患者の脳には、
まず APP の機能について述べる。
APP は Aβ 産生以外に本来の機能をもっているが、本来の機能はそれほど詳しくわかっているわけではない。多くの場合、分解されてそれぞれの断片が機能することも、このタンパク質の役割を複雑にしている要因である (7)。
このページで述べるように、アルツハイマー病と関係が深い 3 つのタンパク質
- プレセニリン
- ApoE
- Tau
は、いずれも APP の切断またはクリアランスに関わる分子である。
- ヘパリン、ラミニンなど細胞外分子と結合する。細胞接着に機能しているかもしれない。
- APP KO mice show deficits in structure and function in neuromuscular synapses (4).
- APP transgenic mice は、シナプス可塑性や記憶力が上昇する (4).
APP からアミロイド β が生じる機構
図は文献 4 から転載。
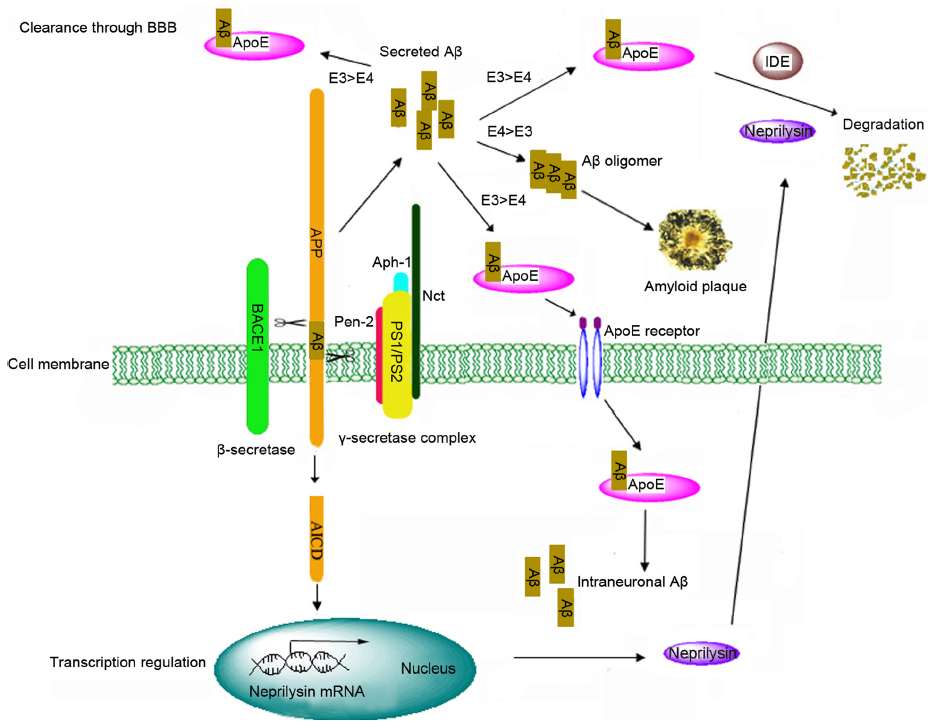
- APP は細胞膜貫通型の糖タンパク質で、プロテアーゼによる分解を受ける。
- 分解は α 経路と β 経路に分けられ、β 経路が amyloid β を生み出す経路である。
- β経路では、β-セクレターゼによって APP が切られ、C 末端側の 99 アミノ酸から成る断片 C99 が膜に残る。
- C99 は γ-セクレターゼによって 38 - 43 アミノ酸のペプチドになり、N 末端側の Aβ が細胞外へ分泌される。
- 残りの部分は AICD (APP intracellular C-terminal domain ) と呼ばれ、核へ移行して neprilysin の転写を促進。
- 通常、γ-secretase は40アミノ酸から成る Aβ40 を生み出すが、同時に毒性の高い Aβ42 も作る。
家族性アルツハイマー病の原因として知られるプレセニリン precenilin は、APP を切断するセクレターゼの構成因子である。変異が切断パターンの違いをもたらすものと推察される。
広告
「あとがき」で当サイトを参考にしたと書いてくれているラノベです。Kindle Unlimited で読めました。ストーリーと文章が良く、面白かったです。
アミロイド β とアルツハイマー病
APP がアルツハイマー病の原因であることの最も有力な証拠は、
- AD と関連した 32 の変異がみつかっており、多くが Aβ42 を生じやすい位置に入っている。
- Aβ の量と認知症の程度については、相関する/しないの両方の報告がある (1)。
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
References
Tiiman 2013a (Review). The missing link in the amyloid cascade of Alzheimer’s diseare - metal ions Neurochem Int 62, 367-378.Gotz 2008a (Review). Animal models of Alzheimer's disease and frontotemporal dimentia. Nat Rev Neurosci 9, 532-544.Kashiwaya 2000a. D-β-hydroxybutyrate protects neurons in models of Alzheimer's and Parkinson's disease. PNAS 97, 5440-5444.Dong et al. 2012a (Review). Advances in the pathogenesis of Alzheimer's disease: a re-evaluation of amyloid cascade hypothesis. Transl Neurodegener 1, 18.- Pittsburgh Compound-B を用いたPETによるアルツハイマー型認知症研究. Link.
Poeggeler et al. 2005a. Mitochondrial medicine: neuroprotection and life extension by the new amphiphilic nitrone LPBNAH1 acting as a highly potent antioxidant agent. J Neurochem 95, 962-973.- アミロイド β 前駆体タンパク質. PDBj 今月の分子. Link.
