In situ ハイブリダイゼーション: 原理、方法など
UBC/experiments/tissue_staining/in_situ
このページの最終更新日: 2025/01/05- 概要: in situ hybridization 法とは
- プローブについて
- プロトコール: 固定
- プロトコール: ハイブリダイゼーション
- プロトコール: 検出
- 蛍光検出
- 化学検出
- トラブルシューティング
広告
概要: In situ hybridization 法とは
In situ hybridization とは、標識した DNA または RNA のプローブを組織上で標的とする遺伝子の mRNA とハイブリダイゼーションさせることで、標的遺伝子の空間分布を調べる実験である。in situ は、「その位置において」という意味のラテン語である。
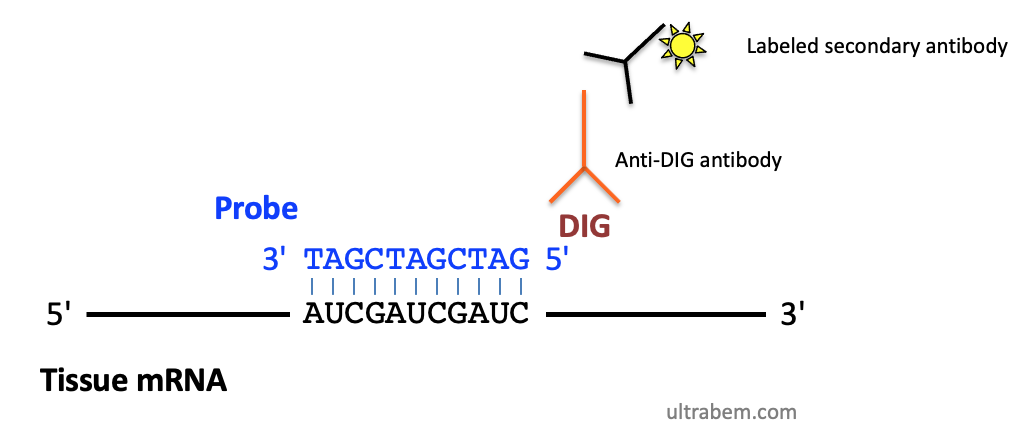
図 (Public domain) は、DIG で標識したプローブを 2 つの抗体で検出する in situ hybridization の原理を示したものである。
組織切片を使った in situ ハイブリダイゼーションでは、下の図 (1) のような染色像が得られる。組織全体がピンクに染まっているのは HE 染色、白い矢尻で示された紺色の部分が in situ ハイブリダイゼーションのシグナルである。
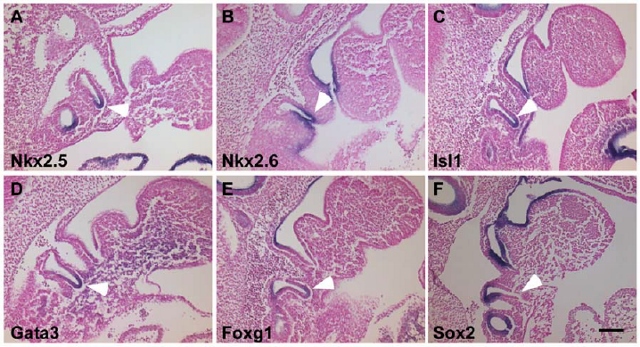
Figure 2. Regionalized expression patterns of Nkx2-5, Nkx2-6, Isl1, Gata3, Foxg1 and Sox2 in the 3rd pharyngeal pouch at E10.5 (30–33 somites). Parasagittal sections (10–14 mm) of embryos that were hybridized to the indicated probes are shown. Anterior is up and dorsal is left. Arrowheads indicate the 3rd pharyngeal pouch. All of the genes are expressed in the ventral 3rd pouch except for Sox2 (F). Scale bar represents 100 mm. doi:10.1371/journal.pone.0026795.g002
プローブについて
DNA or RNA?
ノーザンブロット Northern blot など、他のハイブリダイゼーションを基本原理とする実験でも同じであるが、プローブに求められる条件は
原則として、検出感度が高い → プローブと標的 mRNA の結合力が強い → 特異性も低くなりがちであることから、この条件に合うプローブを開発する努力が続けられてきた。長く使われてきた DNA および RNA プローブに加え、最近では locked nucleic acids (LNA), ペプチド核酸 (peptide nucleic acid, PNA) というプローブが使われている。
| プローブ | メリット | デメリット |
|---|---|---|
| DNA |
|
|
| RNA |
|
|
| LNA |

|
|
| PNA |
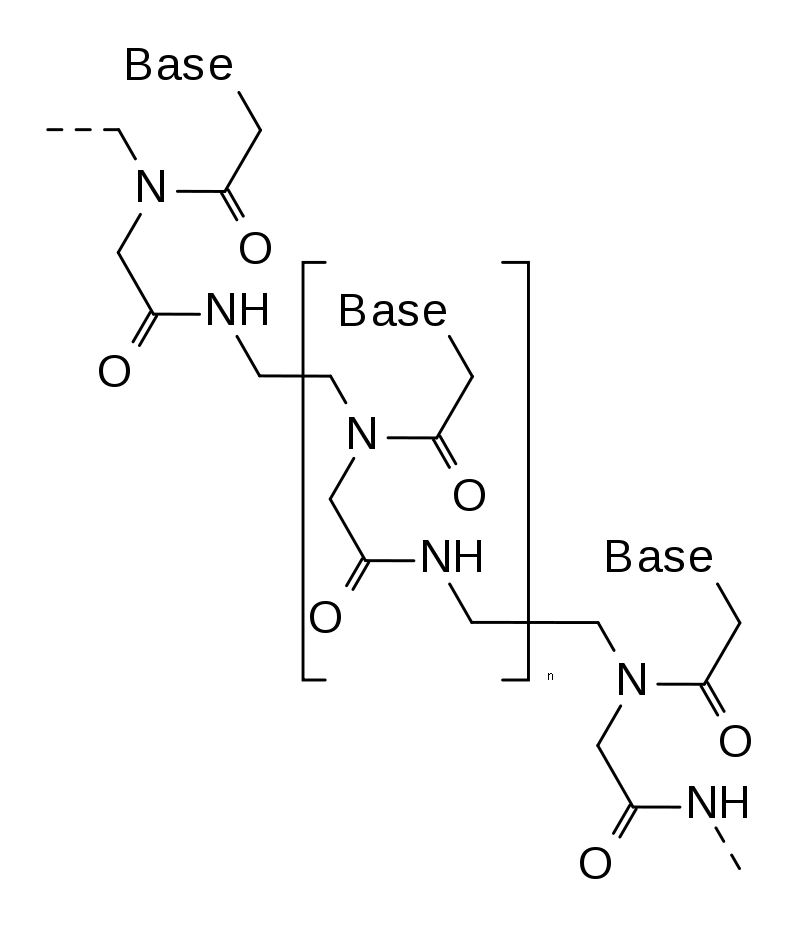
|
|
プローブの長さと検出感度
一般に、プローブが長いと標的 mRNA との結合力が増し、検出感度が高くなる。ただし、細胞内へのプローブの浸透が弱くなる場合もあり、この場合は検出感度が低下してしまう。
プローブの長さは、以上のバランスを考えて設定する。プローブの長さ等に関する記述を集めてみた。ただし、これらはおそらく RNA プローブについての記述である。
- 長さは 0.5 - 1.5 kb を推奨、使用量は 1 解析あたり 2 µg 程度。株式会社 徳島分子病理研究所の受託解析の記述 (3)。
- 文献 5 では、Probes are nucleic acid strands that may be composed of DNA, cDNA or RNA; they may be single-stranded or double-stranded and may vary in length from 20 bases to over 1,500 bases と書かれており、短いオリゴプローブにも言及している。
- BraInSitu の神経系の in situ のまとめ (4)。Non-RI の場合、常に感度が問題になるので、プローブは長い方が良い。700 - 1200 bp くらいだと、加水分解せずにそのまま使えると書かれている。GC 含量は 50% 程度を推奨。3' UTR は特異性が高くて良さそうだが、このページには「変な配列が多いので避けることが多い」と書かれている。
RNA プローブを加水分解した場合、どのように短くなるかを調べた研究がある (Cox 1984)。
t = (Lo - Lf)/(0.11 x Lo x Lf)
記号は
- Lo = もともとのプローブ長 (kb)
- Lf = 断片化後の平均プローブ長 (kb)
- t = 処理時間 (min)
である。
プローブの Tm 値
プロトコール: 固定
プロトコール: ハイブリダイゼーション
ハイブリダイゼーションバッファー
ハイブリダイゼーションの温度
- ハイブリダイゼーションは、Tm 値よりも 15 - 30 ˚C 低い温度で、15 - 20 時間行うのが通例である (8)。
- Tm から 5 - 10 ˚C 低い温度で 12 - 14 時間 (9)。Tm - 5 ˚C なら stringency は高く、完全マッチのハイブリッドのみが形成される。Tm -20 ˚C ではミスマッチもある。RNA プローブを使用する場合、50% ホルムアミド中、50 ˚C で 12 - 14 時間が推奨プロトコール。プローブが 50 塩基以下の DNA なら、低 stringency 条件でハイブリダイゼーションする。
プロトコール: 検出
化学検出
蛍光検出
広告References
Wei et al. 2011a. A focused in situ hybridization screen identifies candidate transcriptional regulators of thymic epithelial cell development and function. PLoS ONE 6, e26795.- ISH 法解説. Link: Last access 2020/03/09.
- 株式会社 徳島分子病理研究所. Link: Last access 2022/01/25.
- BraInSitu. Link: Last access 2022/01/25.
池田ら、2016a. ホールマウント in situ ハイブリダイゼーション (WISH) 法のための機能性ペプチド核酸の設計. 東京家政大学研究紀要 56, 59-65.- By J3D3 - Own work, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=20727722.
- By Mixtures - Own work, CC BY-SA 3.0, https://commons.wikimedia.org/w/index.php?curid=1737834.
小路, 2002a. 光顕in situ ハイブリダイゼーションによる 特異的RNA分 子の細胞質内不均一分布証明. 電子顕微鏡 37, 77-80.- 富士フィルム in situ ハイブリダイゼーション用試薬. Link: Last access 2022/09/27.
Wei et al. (2011a) is an open-access article distributed under the terms of the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited. Also see 学術雑誌の著作権に対する姿勢.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
