SDS-PAGE: 原理、プロトコールなど
UBC/experiments/protein/sds-page
このページの最終更新日: 2024/02/14- 原理
- プロトコール
- 概要
- ゲルの作成
- 電気泳動
- トラブルシューティング
- 関連ページ (ゲルの染色): CBB 染色、銀染色、蛍光染色
広告
原理
SDS-PAGE とは、ドデシル硫酸ナトリウム (SDS; sodium dodecyl sulfate) および ポリアクリルアミドゲル電気泳動 (PAGE; polyacrylamide gel electrophoresis) を用いて、タンパク質 protein を分子量によって分画する手法である。
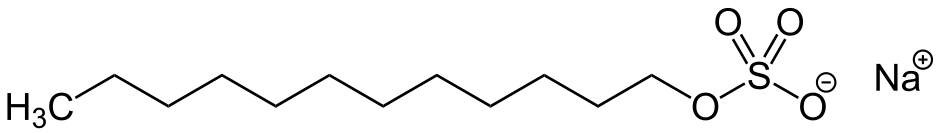
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-O-SO2-ONa
以下の 2 点が SDS-PAGE の原理のポイントである。
- 常に負の電荷をもつ DNA と異なり、タンパク質の電荷はその種類や溶媒の pH などによって変化する。電気泳動を行うには、何らかの方法でタンパク質全体の電荷を揃える必要がある。SDS-PAGE では、SDS がタンパク質に結合して負電荷を与える。
- また、タンパク質はさまざまな高次構造をとる。電気泳動では、ゲルの網目を流れる際の抵抗によってタンパク質をわけるので、分子量が同じでも、球状のタンパク質は早く泳動され、長い紐状のタンパク質はゆっくりと泳動される。そのため、電荷だけでなく高次構造を揃える必要がある。SDS-PAGE では、SDS でタンパク質を変性させ、さらに β-メルカプトエタノールでシステイン cysteine 同士のジスルフィド結合を還元することで、タンパク質を直鎖状にしている。
- 1 g のポリペプチドに対して、1.4 g の SDS が結合しているという計算になる。
プロトコール
概要
以下、SDS-PAGE の手順を順番に解説する。
- ゲルの作成
- 電気泳動
- ゲルの染色
ゲルの作成
最近では既製品のプレキャストゲルを買うのも一般的だが、自分でゲルを作るときには以下の試薬を用いる。
30% アクリルアミド溶液 |
アクリルアミドは、ゲルの網目構造を作り出す物質である。 30% アクリルアミド溶液と書かれることがあるが、実際は w/v で 29% のアクリルアミドと 1% の N,N'-bis-アクリルアミドを含む混合液が使われる。これらの濃度は、製品によって異なることがある (2)。
|
Tris buffer (1.5 M, pH 8.8) |
Resolving gel (separating gel) に使う緩衝液。 |
Tris buffer (1 M, pH 6.8) |
Stacking gel に使うバッファー。 SDS-PAGE ゲルには
|
過硫酸アンモニウム: APS |
フリーラジカルを発生し、アクリルアミドの重合を促進する。 蒸留水で 10% 溶液を作りストックしておく。1 - 2 週ごとに新しいものを使用する (2)。 |
| TEMED |
N,N,N',N'-tetramethylethylenediamine。APS によって作られたフリーラジカルを安定化する試薬。重合を促進する。APS, TEMED ともに重合促進剤と考えるのが妥当である (3)。 |
具体的なプロトコールは、とりあえず以下のサイトを参照。
- SDS ポリアクリルアミドゲルの作製方法。テフコ Pdf file.
- 日本蛋白質化学会のページ、pdf.
電気泳動
必要な試薬は、基本的に泳動バッファーと 2x Laemmli buffer のみ。
泳動バッファー |
以下の組成の Tris-Glycine buffer が一般に使われる。10x バッファーが市販されているが、簡単なので作った方が安いだろう。作る際には、とくに pH を合わせる必要はない。 25 mM Tris, 192 mM Glycine, 0.1% (w/v) SDS. Cold Spring Harber プロトコール では、10 x 溶液を 1 L 作る場合、30.0 g of Tris base, 144.0 g of glycine, and 10.0 g of SDS in 1000 ml of H2O と書かれている。pH は自動的に 8.3 ぐらいになり、調整不要。室温で保存し、1 x を実験に使う。 |
2x Laemmli バッファー |
4% SDS, 20% グリセロール, 10% 2-メルカプトエタノール, 0.004% bromphenol blue and 0.125 M Tris HCl, pH 6.8 (Sigma の製品ページ). サンプルと 1 : 1 の割合で混ぜ、沸騰水中で 3 - 5 分ほど変性させてからゲルにアプライする。 |
一般に stacking gel 中は低電流で泳動し、separating gel に入ったら電流を上げる。私が習ったのは、15 mA - 30 mA ぐらいが普通で、25 mA - 50 mA ぐらいまでなら問題ないという方法だった。
SDS-PAGE の泳動段階でよく議論されるのは、定電流にすべきか、定電圧にすべきか という点である (4)。
ここで考えるべきポイントは、以下の 3 点である。
- オームの法則 V = IR (電圧 = 電流 x 抵抗)
- 電気泳動が進むと、ゲル中の塩化物イオン Cl- が緩衝液中の グリシン やトリシンに置換される。塩化物イオンは導電率が高く、ゲル中を高速で移動するためである (4)。
- そのため、電気泳動中は
抵抗が徐々に上昇する。 - 電気泳動による発熱は、原則としてワット数 (電流 x 電圧) が高いほど大きくなる。
定電圧モードでは、抵抗が上昇すると電流は減少する。したがって、電気泳動が進むにつれてワット数が減少し、発熱も小さくなる。泳動時間は、定電流モードよりも長くなる。
定電流モードでは、抵抗が上昇すると電圧も上昇する。同じ電流を保つためである。したがってワット数も大きくなり、ゲルが発熱する。また、接触不良などによって局所的に抵抗が大きくなっても、発熱が起こる。
ゆえに、
トラブルシューティング
ゲルのスマイリング、酸性サンプルなどにみられる泳動の歪みなど。更新予定。
広告
References
- ページ編集の際に削除
Green and Sambrook, 2012a. Molecular cloning: A laboratory manual, 4th edition. Cold Spring Harbor Laboratory Press.
|
分子生物学関係のプロトコール集では、この本よりも有名なものはないだろう。 日本語版がない、電子書籍版もない、値段が高い、重い (3 冊組でとどく) など問題点は多々あるが、それでも実験室に必ずあるべき書。ラボプロトコールをまとめたりする時間を大いに節約することができる。 このサイトにあるプロトコールも、多くはこの本の記述を参考にしたものである。 |
|
- 効率の上がる核酸実験法 第3回 変性ポリアクリルアミドゲル電気泳動 (III). 実験医学.
- Thermofisher タンパク質電気泳動における電力の設定. Link: Last access 2019/05/29.
コメント欄
サーバー移転のため、コメント欄は一時閉鎖中です。サイドバーから「管理人への質問」へどうぞ。
